题目内容
由硫可制得多硫化钠![]() ,
,![]() 值一般为2-6.已知:
值一般为2-6.已知:![]() 与
与![]() 的反应的化学方程式如下:
的反应的化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
试配平上述反应方程式.若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2∶1,试从求得的![]() 值写出该多硫化钠的化学式.
值写出该多硫化钠的化学式.
答案:
解析:
提示:
解析:
|
在
由 再按照钠原子守恒确定NaOH的系数,即 按照氢原子守恒确定 |
提示:
|
确定 |

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
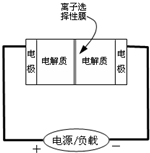 由硫可制得多硫化钠Na2Sx,x的值一般为2~6.当x=2时,多硫化钠称为过硫化钠.
由硫可制得多硫化钠Na2Sx,x的值一般为2~6.当x=2时,多硫化钠称为过硫化钠.





