题目内容
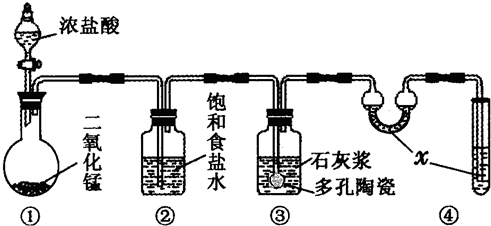
 某研究性学习小组利用如图所示装置完成有关实验.
某研究性学习小组利用如图所示装置完成有关实验.【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入
【实验二】收集 NO
(2)利用装置Ⅱ可收集 NO,试简述操作方法:
【实验三】比较硫、碳、硅三种元素的非金属性强弱
(3)设计实验,完成表格(可以不填满,也可以再加行)
| 装置序号 | 仪器中所加物质名称 | 现象 |
分析:(1)根据浓氨水的电离平衡选择药品;根据氨气的密度比空气的小选择收集方法;
(2)根据一氧化氮的化学性质,必须使用排水法收集一氧化氮;
(3)根据非金属的最高价氧化物对应的水化物酸性越强,非金属越强设计实验检验硫、碳、硅三种元素的非金属性强弱.
(2)根据一氧化氮的化学性质,必须使用排水法收集一氧化氮;
(3)根据非金属的最高价氧化物对应的水化物酸性越强,非金属越强设计实验检验硫、碳、硅三种元素的非金属性强弱.
解答:解:(1)浓氨水中存在电离平衡,可以加入生石灰(或者氢氧化钠)增大氨水中的氢氧根离子浓度,能够快速产生氢气;由于氨气的密度小于空气的密度,所以采用向上排空气法收集氨气,即从d管口进入氨气,
故答案为:生石灰(或氢氧化钠);d;
(2)由于一氧化氮能够与空气中的氧气反应生成二氧化氮,且一氧化氮不溶于水,所以只能采用排水法收集一氧化氮,若利用装置Ⅱ可收集NO,可以将广口瓶中装满水,一氧化氮从d管口进入即可,
故答案为:将广口瓶中装满水,一氧化氮从d管口进入;
(3)比较硫、碳、硅三种元素的非金属性强弱,可以利用它们的最高价氧化物对应的水化物的酸性强弱判断,即酸性:硫酸>碳酸>硅酸,
装置Ⅰ中,a分液漏斗中装入稀硫酸,b圆底烧瓶中加入碳酸钠固体,反应的稀硝酸为:固体溶解,有气泡产生,证明硫酸酸性大于碳酸的;
装置Ⅱ或者Ⅲ中,盛有硅酸钠溶液,装置Ⅰ产生的二氧化碳能够与硅酸钠反应生成白色胶状沉淀,
故答案为:
.
故答案为:生石灰(或氢氧化钠);d;
(2)由于一氧化氮能够与空气中的氧气反应生成二氧化氮,且一氧化氮不溶于水,所以只能采用排水法收集一氧化氮,若利用装置Ⅱ可收集NO,可以将广口瓶中装满水,一氧化氮从d管口进入即可,
故答案为:将广口瓶中装满水,一氧化氮从d管口进入;
(3)比较硫、碳、硅三种元素的非金属性强弱,可以利用它们的最高价氧化物对应的水化物的酸性强弱判断,即酸性:硫酸>碳酸>硅酸,
装置Ⅰ中,a分液漏斗中装入稀硫酸,b圆底烧瓶中加入碳酸钠固体,反应的稀硝酸为:固体溶解,有气泡产生,证明硫酸酸性大于碳酸的;
装置Ⅱ或者Ⅲ中,盛有硅酸钠溶液,装置Ⅰ产生的二氧化碳能够与硅酸钠反应生成白色胶状沉淀,
故答案为:
| 装置序号 | 仪器中所加物质名称 | 现象 |
| Ⅰ | a稀硫酸、b碳酸钠固体 | 固体溶解,有气泡产生 |
| Ⅱ或Ⅲ | 硅酸钠溶液 | 有白色胶状沉淀生成 |
点评:本题考查了氨气的实验室制法、非金属性强弱比较、一氧化氮的收集方法,难度不大,可以根据氨气、一氧化氮的性质及元素周期律等知识完成.

练习册系列答案
相关题目


 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验. )
)