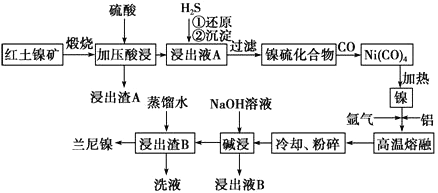
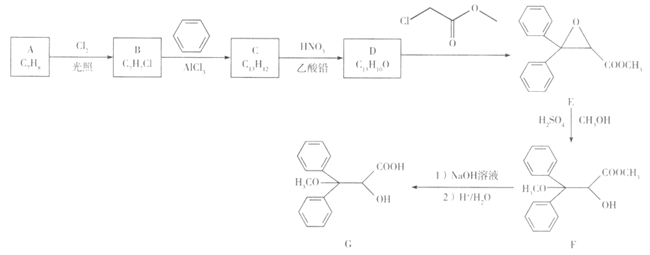
题目内容
【题目】某恒温固定体积为2 L密闭容器中,发生反应:2SO2(g)+ O2(g) ![]() 2SO3(g) ΔH <0,n(SO2)随时间的变化如表:
2SO3(g) ΔH <0,n(SO2)随时间的变化如表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A. 当容器中气体的密度不变时,说明该反应已达到平衡状态
B. 用O2表示0~4 min内该反应的平均速率为0.005 mol/(L·min)
C. 若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D. 平衡时再通入18O2,平衡右移,再次平衡时各物质均含有18O,O2的转化率减小
【答案】D
【解析】A. 因反应前后气体的质量不变,容器的体积也不变,则混合气体的密度始终不变,所以容器中气体的密度不变时,不能说明该反应已达到平衡状态,故A错误;B. 由表中数据可知,0~4 min内v(SO2)=(0.2-0.08)mol÷2L÷4min=0.015mol/(L·min),则v(O2)=v(SO2)÷2=0.0075mol/(L·min),故B错误;C. 升高温度,用SO2表示的反应速率增大,但该可逆反应为放热反应,升高温度,平衡逆向移动,平衡常数K将减小,故C错误;D. 平衡时再通入18O2,氧气的浓度增大,平衡向右移动,因该反应是可逆反应,则再次平衡时各物质均含有18O,增大氧气的浓度,可以提高二氧化硫的转化率,自身转化率降低,即O2的转化率减小,故D正确;答案选D。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目