题目内容
20.用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
| A. | 放电时,OH-向镍电极作定向移动 | |
| B. | 放电时,负极的电极反应为:H2-2e-+2OH-═2H2O | |
| C. | 充电时,将电池的碳电极与外电源的正极相连 | |
| D. | 充电时,阴极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
分析 开关连接用电器时,应为原电池原理,则根据电子流向,镍电极为正极得电子发生还原反应;开关连接充电器时,镍电极为阳极失电子发生的电极反应Ni(OH)2+OH--e-=NiO(OH)+H2O;
A、放电时,电解质溶液中阴离子向负极移动;
B、放电时,负极上氢气失电子发生氧化反应;
C、该电池充电时,碳电极与电源的负极相连;
D、充电时,阳极上发生失电子的氧化反应.
解答 解:开关连接用电器时,应为原电池原理,则根据电子流向,镍电极为正极得电子发生还原反应;开关连接充电器时,镍电极为阳极失电子发生的电极反应Ni(OH)2+OH--e-=NiO(OH)+H2O,
A、放电时,该电池为原电池,电解质溶液中阴离子向负极移动,所以OH-移向碳电极,故A错误;
B、放电时,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,故B正确;
C、该电池充电时,碳电极附近物质要恢复原状,则应该得电子发生还原反应,所以碳电极作阴极,应该与电源的负极相连,故C错误;
D、充电时,阳极上发生失电子的氧化反应,即Ni(OH)2+OH--e-=NiO(OH)+H2O,故D错误;
故选:B.
点评 本题考查了原电池和电解池原理,明确正负极上发生的电极反应及阴阳离子的移动方向即可解答,注意结合电解原理确定与原电池哪个电极相连,为易错点.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 高温、高压、催化剂条件下,1 mol N2与足量H2充分反应转移的电子数为6 NA | |
| B. | 将NO2和NO混合,标准状况下,22.4 L混合气体中所含的氮原子总数为2 NA | |
| C. | 常温下,10 L pH=12的Na2CO3溶液中含有的OH-离子数为0.1NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
6.将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Ca2+、NO3- | ||
| C. | Na+、AlO2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
 铜及其化台物在工业、农业、科技和日常生活中有广泛应用.
铜及其化台物在工业、农业、科技和日常生活中有广泛应用.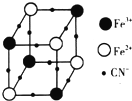 过渡金属元素及其化合物在合金材料以及催化剂等方面应用非常广泛.
过渡金属元素及其化合物在合金材料以及催化剂等方面应用非常广泛.
 互为同分异构体
互为同分异构体 和
和 是同一种物质
是同一种物质