题目内容
【题目】下列正确的叙述有()
A.CO2、NO2均为酸性氧化物,CaO、Na2O2均为碱性氧化物
B.Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应和复分解反应来制取Fe(OH)3
C.灼热的炭与CO2反应、![]() 与
与![]() 的反应均可设计成原电池
的反应均可设计成原电池
D.电解、电泳、电离、电镀、电化学腐蚀过程均需要通电才能发生
【答案】B
【解析】
A.NO2不是酸性氧化物,Na2O2 和酸反应生成盐和水的同时生成氧气,发生了氧化还原反应,属于过氧化物,故A错误;
B.Fe2O3不溶于水,不与水反应得到Fe(OH)3;氢氧化亚铁与氧气、水共同作用,发生化合反应生成氢氧化铁,氯化铁和氢氧化钠复分解反应来制取Fe(OH)3,故B选项正确。
C.![]() 与
与![]() 的反应属于复分解反应,不是氧化还原反应,不可设计成原电池,故C选项错误。
的反应属于复分解反应,不是氧化还原反应,不可设计成原电池,故C选项错误。
D.电离是电解质在水溶液或熔融状态下产生自由移动的离子的过程,不需要通电,故D选项错误。
故答案选B。

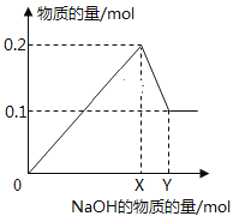
【题目】为确定某NH4NO3和(NH4)2SO4混合物的组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(加热后氨气全部逸出)。加入的混合物的质量和产生的气体体积(标准状况)的关系如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
NaOH溶液体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=________g;c(NaOH)=___________ mol·L-1
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为______________。
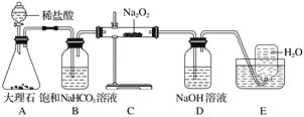
【题目】下列操作对应的现象不符合事实的是
|
|
|
|
A.将二氧化碳气体通入CaCl2溶液,不会产生白色沉淀 | B.用激光笔照射Fe(OH)3胶体,产生“丁达尔效应” | C.将湿润的有色布条放入盛有干燥氯气的瓶中,布条不褪色 | D.将滴管中的浓盐酸加入碳酸氢钠溶液,气球体积由小变大 |
A. A B. B C. C D. D