题目内容
A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期.C、B可按原子个数比2∶1和1∶1分别形成两种离子化合物甲和乙.A原子的最外层电子数比次外层电子层多3个.E是地壳中含量最高的金属元素.根据以上信息回答下列问题:
(1)D元素在周期表中的位置是________,A的最高价氧化物的化学式是________.
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)________.
(3)E的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物发生反应的化学方程式是________.
(4)简述比较D与E金属性强弱的实验方法;________.
答案:
解析:
解析:
|
(1)第三周期第ⅡA族(1分),(不写全得0分) N2O5(1分) (2)O<N<Al<Mg<Na(2分) (3)Al(OH)3+NaOH=NaAlO2+2H2O(2分) (4)镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应.(其他答案合理也可以给分).(3分) |

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
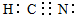
 CH3COOH+OH-
CH3COOH+OH- 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是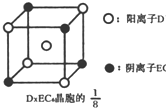
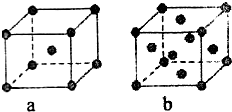 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.