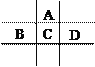题目内容
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | IB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
(2)M2Z的熔点比M2W的_________(填“高”或“低”) ,请解释原因___________ 。
(3)N3-和YZ2是等电子体,则N3-的结构式为_________________ 。
(4)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为______________________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图1所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图2中字母) ,该分子中含有___个σ键。
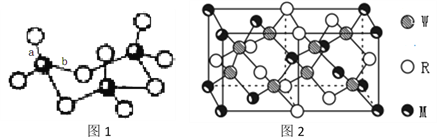
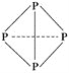
(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与_______个W原子相连,晶体密度ρ=_______g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023mol-1)。
【答案】 O [Ar]3d9 高 氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高 [N=N=N]- 3 平面三角形 sp2 sp3 a 12 4 ![]()
【解析】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大。Y的原子核外有6个不同运动状态的电子,Y为C元素; Z 是非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,Z的电子排布式为1s22s22p4,为O元素;W是主族元素,与Z原子的价电子数相同 ,W为S元素;R 的价层电子排布式为3d64s2,R为Fe元素;M位于第IB族,其被称作“电器工业的主角”,为Cu元素。
(1)因为Z为O、W为S,非金属性为O>S,所以第一电离能是O>S,M为Cu元素,为29号元素,Cu2+的核外电子排布式为[Ar]3d9。
(2)由上述分析知M2Z的化学式为Cu2O,M2W的化学式为Cu2S。因为氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高。答案:高;氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高 。
(3由上述分析知YZ2的化学式为CO2, N3-是CO2的等电子体,所以N3-的结构式为[N=N=N]-。
(4)WZ2的分子式为SO2, SO2中W原子价层电子对数是中心原子的孤对电子对数和![]() 键电子对数之和,中心原子的孤对电子对数=(6-2
键电子对数之和,中心原子的孤对电子对数=(6-2![]() )/2=1
)/2=1![]() 键电子对数为2,所以S原子价层电子对数是3对。SO2的VSEPR 模型名称为平面三角形。SO3气态为单分子,该分子中S原子形成3个δ键,没有孤对电子,则为sp2杂化,SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12。
键电子对数为2,所以S原子价层电子对数是3对。SO2的VSEPR 模型名称为平面三角形。SO3气态为单分子,该分子中S原子形成3个δ键,没有孤对电子,则为sp2杂化,SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12。
(5)由图知每个Cu原子和4个S原子相连,S均在体内,由此知化学式为CuFeS2,则含晶胞质量为![]() ,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=
,晶胞参数a=0.524nm,c=1.032nm,体积为(0.524×10-7cm)2×1.032×10-7cm,ρ=![]() =
=![]() =
= gcm-3,故答案为:4;
gcm-3,故答案为:4;
![]()

 阅读快车系列答案
阅读快车系列答案