��Ŀ����
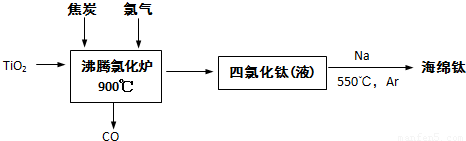
��ҵ��ұ������Ҫ���������ʯ����TiO2����96%����Ϊԭ��������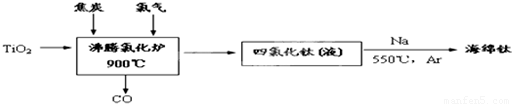
��1���ɽ��ʯΪԭ�ϲ��ú��أ�Hunter���������ѵ��������£�
�ٷ����Ȼ�¯�з�Ӧ�Ļ�ѧ����ʽΪ��______
����֪��Ti��s��+2Cl2��g��=TiCl4��l����H=-804.2kJ/mol��
2Na��s��+Cl2��g��=2NaCl��s����H=-882.0kJ/mol
Na��s��=Na��l����H=2.6kJ/mol
��д����Һ̬�������Ȼ����û����ѵ��Ȼ�ѧ����ʽ______
�ۺ������������0.5%��1.5%������ϴ�ӣ���������ˮϴ�������ԣ�������ϴ�ӵ�Ŀ����______��
��2����ѧ�Ҵӵ��ұ�����Ĺ��յõ��������ҳ���ұ���ѵ��¹��գ��Իش������й����⣮
��TiO2ֱ�ӵ�ⷨ�����ŷ�����������һ�ֽ��Ƚ��ķ����������Ϊ���ڵ��Ȼ��ƣ�ԭ����ͼ��ʾ��������������ԭ��Ca��һ����ԭTiO2����ѣ����������������ķ�ӦΪ��______��
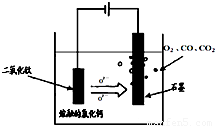
��SOM������һ����ɫ�����Ƚ������������ý����մɣ����ù��������Ӹ�Ĥ���������������ֻ����������ͨ�����ڵ�����������ͨ��ij�ֻ�ԭ�����壬�ɷ�ֹCO��CO2��Ⱦ�������ͨ�����������H2����������ⷴӦʽΪ______��
���𰸡���������1���ٸ��ݷ���¯�еķ�Ӧ���Լ���ҵԭ������д��ѧ����ʽ��
�ڸ��ݸ�˹���������㻯ѧ��Ӧ���ʱ䲢��д�Ȼ�ѧ����ʽ��
�۸��ݺ����ѵijɷ���ȷ������ϴ�����ã�
��2�����ڵ��ص��������е�����е������ӷ����õ��ӵĻ�ԭ��Ӧ��
���ڵ��ص������Ϸ���ʧ���ӵĻ�ԭ��Ӧ��
����⣺��1���ٷ���¯�еķ�Ӧ����TiO2��2Cl2��2C��Ӧ������TiCl4��2CO����������ѧ��Ӧ��TiO2+2Cl2+2C=TiCl4+2CO���ʴ�Ϊ��TiO2+2Cl2+2C=TiCl4+2CO��
�ڣ�I�� Ti��s��+2Cl2��g��=TiCl4��l����H=-804.2 kJ/mol��
��II�� 2Na��s��+Cl2��g��=2NaCl��s����H=-882.0kJ/mol��
��III�� Na��s��=Na��l����H=2.6kJ/mol��
������ʽ2��II��-��I��-��III����TiCl4��l��+4Na��l��=Ti��s��+4NaCl��s����
��H=2��-882.0kJ/mol��-��-804.2kJ/mol��-2.6kJ/mol=-970.2kJ/mol
�ʴ�Ϊ��4Na��l��+TiCl4��l��=4NaCl��s��+Ti��s����H=-970.2kJ/mol��
�ۺ������к����ơ��Ȼ��ƺ��ѵĵͼ��Ȼ�������ܺ��Ʒ�Ӧ�������ܽ��Ȼ��Ƽ��ѵĵͼ��Ȼ���Ӷ��õ��ϴ����ѣ�
�ʴ�Ϊ����ȥ���еĹ������Ʋ��ܽ��Ȼ��Ƽ��ѵĵͼ��Ȼ��
��2���ٵ��ʱ�������ϵõ��ӷ�����ԭ��Ӧ�����Զ������ѵõ��������Ѻ������ӣ��缫��ӦʽΪ2Ca2++4e-+TiO2=2CaO+Ti���ʴ�Ϊ��2Ca2++4e-+TiO2=2CaO+Ti��
�ڵ�����������ͨ�뻹ԭ����������������ʧ���ӵĻ�ԭ��Ӧ������H2+O2--2e-=H2O���ʴ�Ϊ��H2+O2--2e-=H2O��
���������⿼���˽�����ұ�����缫��Ӧʽ����д���Ȼ�ѧ��Ӧ��֪ʶ�㣬ע���ʱ���йؼ��㡢�缫��Ӧʽ����д�Ǹ߿����ȵ㣬Ӧ�ص����գ�
�ڸ��ݸ�˹���������㻯ѧ��Ӧ���ʱ䲢��д�Ȼ�ѧ����ʽ��
�۸��ݺ����ѵijɷ���ȷ������ϴ�����ã�
��2�����ڵ��ص��������е�����е������ӷ����õ��ӵĻ�ԭ��Ӧ��
���ڵ��ص������Ϸ���ʧ���ӵĻ�ԭ��Ӧ��
����⣺��1���ٷ���¯�еķ�Ӧ����TiO2��2Cl2��2C��Ӧ������TiCl4��2CO����������ѧ��Ӧ��TiO2+2Cl2+2C=TiCl4+2CO���ʴ�Ϊ��TiO2+2Cl2+2C=TiCl4+2CO��
�ڣ�I�� Ti��s��+2Cl2��g��=TiCl4��l����H=-804.2 kJ/mol��
��II�� 2Na��s��+Cl2��g��=2NaCl��s����H=-882.0kJ/mol��
��III�� Na��s��=Na��l����H=2.6kJ/mol��
������ʽ2��II��-��I��-��III����TiCl4��l��+4Na��l��=Ti��s��+4NaCl��s����
��H=2��-882.0kJ/mol��-��-804.2kJ/mol��-2.6kJ/mol=-970.2kJ/mol
�ʴ�Ϊ��4Na��l��+TiCl4��l��=4NaCl��s��+Ti��s����H=-970.2kJ/mol��
�ۺ������к����ơ��Ȼ��ƺ��ѵĵͼ��Ȼ�������ܺ��Ʒ�Ӧ�������ܽ��Ȼ��Ƽ��ѵĵͼ��Ȼ���Ӷ��õ��ϴ����ѣ�
�ʴ�Ϊ����ȥ���еĹ������Ʋ��ܽ��Ȼ��Ƽ��ѵĵͼ��Ȼ��
��2���ٵ��ʱ�������ϵõ��ӷ�����ԭ��Ӧ�����Զ������ѵõ��������Ѻ������ӣ��缫��ӦʽΪ2Ca2++4e-+TiO2=2CaO+Ti���ʴ�Ϊ��2Ca2++4e-+TiO2=2CaO+Ti��
�ڵ�����������ͨ�뻹ԭ����������������ʧ���ӵĻ�ԭ��Ӧ������H2+O2--2e-=H2O���ʴ�Ϊ��H2+O2--2e-=H2O��
���������⿼���˽�����ұ�����缫��Ӧʽ����д���Ȼ�ѧ��Ӧ��֪ʶ�㣬ע���ʱ���йؼ��㡢�缫��Ӧʽ����д�Ǹ߿����ȵ㣬Ӧ�ص����գ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ

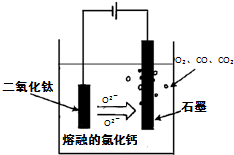
 ��������ѿ��ܷ����ķ�Ӧ��缫��ӦΪ��
��������ѿ��ܷ����ķ�Ӧ��缫��ӦΪ�� ������˵����ȷ����
������˵����ȷ����


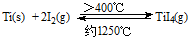
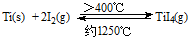 ������˵����ȷ����______��
������˵����ȷ����______��