题目内容
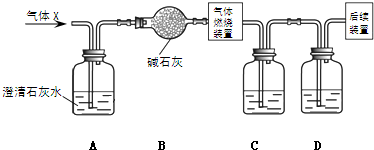
某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几钟.将X通过适量的氯水时,X完全被吸收.将所得的无色溶液分装于两支试管后,分别加入酸化AgNO3与BaCl2溶液,结果均产生白色沉淀.下列推论正确的是( )
分析:能与氯气反应的有SO2、HBr,加入酸化的BaCl2溶液,结果产生白色沉淀,说明一定有SO2,沉淀为硫酸钡;加入酸化的AgNO3溶液,产生白色沉淀为氯化银,但氯水中含有氯元素,不能确定原气体含氯化氢.
解答:解:将X通过适量的氯水时,X恰好完全反应,没有任何气体剩余,能与氯气反应的有SO2、HBr,所得溶液是无色溶液,判断气体中一定无HBr;加入酸化的BaCl2溶液,结果产生白色沉淀,说明一定有SO2,沉淀为硫酸钡;加入酸化的AgNO3溶液,产生白色沉淀为氯化银,但氯水中含有氯元素,不能确定原气体含氯化氢.二氧化碳依据混合气体中含量多少,可能被完全吸收,也可能不能被完全吸收,所以二氧化碳不一定含有;
故选B.
故选B.
点评:本题考查常见离子的检验,难度不大,注意离子检验中的排除干扰是检验的关键,平时注意知识的积累.

练习册系列答案
相关题目


 如图,X和Y均为石墨电极:
如图,X和Y均为石墨电极: