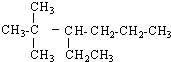题目内容
17.CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414 | 615 | 347 | 435 |
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:在反应CH3-CH3→CH2=CH2+H2中,断裂6mol C-H键,1mol C-C键共吸收的能量为:6×414kJ+347kJ=2831kJ,
生成1molCH2=CH2和1molH2,共形成4molC-H键,1molC=C、1molH-H,共放出的能量为:4×414kJ+615kJ+435kJ=2706kJ,
吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2831kJ-2706kJ=125,所以反应热为+125kJ/mol,
故答案为:+125 kJ/mol.
点评 本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列说法中,正确的是( )
| A. | 分子数相同的气体,它们的体积一定相等 | |
| B. | 高温时,气体体积一定比低温时的体积大 | |
| C. | 相同状况下,物质的量相同的两种气体的体积相同 | |
| D. | 压强大时,气体体积一定比压强小时的体积小 |
2.在下列物质中,既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,还能使紫色石蕊试液变为红色的是( )
| A. | 苯 | B. | 苯酚 | C. | 丙烯酸 | D. | 甲酸甲酯 |
9.对于反应4NH3+5O2=4NO+6H2O,下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是( )
| A. | v(NH3)=0.2mol(L•s) | B. | v(O2)=1.4mol(L•min) | C. | v(H2O)=0.2mol(L•s) | D. | v(NO)=9mol(L•min) |
6.按酸、碱、盐、氧化物的顺序排列的一组物质是( )
| A. | H2SO4 Na2CO3 NaCl CuO | |
| B. | H2O Ca(OH)2 HCl Na2SO4 | |
| C. | H2SO4 NaOH Na2CO3 Fe2O3 | |
| D. | NaOH H2CO3 NaCl CO2 |
7.下列物质的分子中既有σ键,又有π键,并含有非极性键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2.
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2.
| A. | ①②③ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
 碳碳双键
碳碳双键 3-甲基-2-乙基-1-戊烯④
3-甲基-2-乙基-1-戊烯④ 2-甲基戊烷
2-甲基戊烷 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O. 2-甲基戊烷
2-甲基戊烷