题目内容
 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
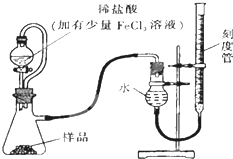
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.(1)某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.
①实验前需进行的操作是
②分液漏斗上端连接的橡皮管的作用是
③实验结束后,待恢复至室温,先
(2)实验室还可通过以下方案测定样品中过氧化镁的含量:
取a g样品,加入足量稀盐酸,充分反应后再加入NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体.
已知:常温下Ksp[Mg(OH)2]=1×10-11.为使溶液中的Mg2+完全沉淀[即溶液中c(Mg2+)≤1×10-4mol/L],溶液的pH至少应调至
(3)实验室中某含Mg2+的溶液中混有Fe3+,可用Mg(OH)2调溶液PH值除去Fe3+,写出该沉淀转化反应的离子方程式
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)①实验前需进行的操作是检查装置的气密性;通过测量双氧水分解生成的氧气,可检测过氧化镁的含量,而氯化铁能作催化剂加快双氧水的分解,加快反应速率,过氧化镁是离子化合物,据此写出电子式;
②气体的体积受温度和压强影响大,分液漏斗上端连接的橡皮管的作用是保持恒压,用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下;
③应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数;
(2)根据氢氧化镁的溶度积,计算出溶液中氢氧根离子的浓度,求出溶液的PH;质量b是氧化镁,质量a是过氧化镁和氧化镁杂质质量,设出二者物质的量,列式计算出各自物质的量,最后根据过氧化镁的物质的量,算出其质量分数;
(3)用Mg(OH)2调溶液PH值除去Fe3+,利用氢氧化镁和溶液中氢离子反应促进铁离子水解正向进行,生成氢氧化铁沉淀.
②气体的体积受温度和压强影响大,分液漏斗上端连接的橡皮管的作用是保持恒压,用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下;
③应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数;
(2)根据氢氧化镁的溶度积,计算出溶液中氢氧根离子的浓度,求出溶液的PH;质量b是氧化镁,质量a是过氧化镁和氧化镁杂质质量,设出二者物质的量,列式计算出各自物质的量,最后根据过氧化镁的物质的量,算出其质量分数;
(3)用Mg(OH)2调溶液PH值除去Fe3+,利用氢氧化镁和溶液中氢离子反应促进铁离子水解正向进行,生成氢氧化铁沉淀.
解答:
解:(1)①实验装置连接好以后,实验前需进行的操作是检查装置的气密性;过氧化镁溶于水生成双氧水,双氧水易分解,通过测量双氧水分解生成的氧气,可检测过氧化镁的含量,而氯化铁能作催化剂加快双氧水的分解,加快反应速率,过氧化镁是离子化合物,据此写出电子式为 ;
;
故答案为:检查装置的气密性;用作催化剂(或催化H2O2的分解); ;
;
②由于气体的体积受温度和压强影响大,所以用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下,
故答案为:保持恒压使分液漏斗中的溶液顺利滴下;
③由于气体大体积受压强影响大,所以在读数之前,应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数,
故答案为:将右侧刻度管缓缓向下移动直到两侧液面相平;
(2)根据氢氧化镁的溶度积常数可知,当溶液中c(Mg2+)=l×10-5mol/L时,Ksp[Mg(OH)2]=1×10-11=c(Mg2+)?c2(OH-),溶液中OH-浓度等于1×10-3mol/L,所以溶液的pH=11;
设过氧化镁的物质的量是xmol,氧化镁物质的量是ymol,则56x+40y=a,(x+y)×40=b,解得x=
,方案I中过氧化镁的质量分数为:
=
,
故答案是:11;
;
(3)用Mg(OH)2调溶液PH值除去Fe3+,利用氢氧化镁和溶液中氢离子反应促进铁离子水解正向进行,生成氢氧化铁沉淀,反应的;离子方程式为:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3,故答案为:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3.
 ;
;故答案为:检查装置的气密性;用作催化剂(或催化H2O2的分解);
 ;
;②由于气体的体积受温度和压强影响大,所以用恒压分液漏斗的优点还有消除滴入溶液的体积对所测气体体积的影响,使分液漏斗中的溶液顺利滴下,
故答案为:保持恒压使分液漏斗中的溶液顺利滴下;
③由于气体大体积受压强影响大,所以在读数之前,应该将右侧刻度管缓缓向下移动直到两侧液面相平,然后再平视刻度线读数,
故答案为:将右侧刻度管缓缓向下移动直到两侧液面相平;
(2)根据氢氧化镁的溶度积常数可知,当溶液中c(Mg2+)=l×10-5mol/L时,Ksp[Mg(OH)2]=1×10-11=c(Mg2+)?c2(OH-),溶液中OH-浓度等于1×10-3mol/L,所以溶液的pH=11;
设过氧化镁的物质的量是xmol,氧化镁物质的量是ymol,则56x+40y=a,(x+y)×40=b,解得x=
| a-b |
| 16 |
| ||
| a |
| 7(a-b) |
| 2a |
故答案是:11;
| 7(a-b) |
| 2a |
(3)用Mg(OH)2调溶液PH值除去Fe3+,利用氢氧化镁和溶液中氢离子反应促进铁离子水解正向进行,生成氢氧化铁沉淀,反应的;离子方程式为:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3,故答案为:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3.
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力;该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力.

练习册系列答案
相关题目
一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0.现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
| B、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| D、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
下列分散系中,属于胶体的是( )
| A、石灰水 | B、三氯化铁溶液 |
| C、蛋白质溶液 | D、稀硫酸 |
下列有关化学实验的叙述正确的是( )
| A、用带玻璃塞的试剂瓶保存Na2CO3溶液 |
| B、配制FeCl3溶液时,向溶液中加入少量铁粉和稀盐酸 |
| C、在铁件表面镀铜时,用铁件作阴极、铜作阳极、稀硫酸作电镀液 |
| D、实验室进行肥皂反应时,在油脂和氢氧化钠的混合液中加入适量酒精 |
 已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol
已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol