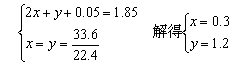题目内容
使一定质量的Zn与100mL 18.5 mol•L-1浓硫酸充分反应,Zn完全溶解,同时生成标准状况下的气体A33.6L。将反应后的溶液稀释至1L,测得溶液c(H+)=0.1mol•L-1,求气体A中各组分的体积比。
解析:
| 反应后溶液体积为1L,c(H+)=0.1 mol•L-1,则n(H+)=1×0.1=0.1(mol),故反应后溶液中剩余硫酸为0.05 mol。
由于浓硫酸在与Zn反应过程中浓度变稀.有SO2、H2两种气体产生。 设SO2的物质的量为x mol,H2的物质的量为y mol,有 Zn + 2H2SO4(浓) = ZnSO4 + SO2↑ + 2H2O 2x mol x mol Zn + H2SO4(稀) = ZnSO4 + H2↑ y mol y mol
所以 V(SO2):V(H2)=(0.3×22.4) : (1.2×22.4)=1:4
|

在一次兴趣小组活动中,一小组利用物质间的互变,设计成一平面“魔方”如图所示。已知:
①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反
应生成不溶于稀硝酸的白色沉淀;B也能将一种能形成酸
雨的氧化物氧化为F,F是一种含氧酸,且F的稀溶液
能与A反应生成E和G。
| 物质 | 纯A(单质) | B(溶液) | D(固体) | G(溶液) |
| 颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
③几种物质的部分物理性质:
依据以上信息填空:
(1)G生成C的过程中所出现的现象为 ;
(2)写出下列反应的化学方程式:
A→B : ;
(3)写出下列反应的离子方程式:
B→F: ;
酸性条件下,G与次氯酸溶液反应: ;
(4)使一定质量的Zn与100mL18.5 mol·L-1 酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体A 33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1,则气体A的成份及体积比为 。
(10分)在一次兴趣小组活动中,一小组同学利用物质间的互变,设计成一平面“魔方”如图所示。已知:
①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体,B与硝酸银溶液反应生
成不溶于稀硝酸的沉淀;B也能将一种能形成酸雨的氧化物氧化
为F,F是一种含氧酸,且F的稀溶液能与A反应生成E和G。
③几种物质的部分物理性质为:
| 物质 | 纯A(单质) | B(溶液) | D(固体) | G(溶液) |
| 颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
(1)G生成C的过程中所出现的现象为 ;
(2)写出下列反应化学方程式:A→B: ;
(3)写出下列反应的离子方程式:B→F: ;
酸性条件下,G与次氯酸溶液反应: ;
(4)使一定质量的Zn与100ml18.5mol·L-1酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)="0.1" mol·L-1,则气体的成分及体积比为 。
在一次兴趣小组活动中,一小组利用物质间的互变,设计成一平面“魔方”如图所示。已知:

①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反
应生成不溶于稀硝酸的白色沉淀;B也能将一种能形成酸
雨的氧化物氧化为F,F是一种含氧酸,且F的稀溶液
能与A反应生成E和G。
|
物质 |
纯A(单质) |
B(溶液) |
D(固体) |
G(溶液) |
|
颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
③几种物质的部分物理性质:
依据以上信息填空:
(1)G生成C的过程中所出现的现象为 ;
(2)写出下列反应的化学方程式:
A→B : ;
(3)写出下列反应的离子方程式:
B→F: ;
酸性条件下,G与次氯酸溶液反应: ;
(4)使一定质量的Zn与100mL18.5 mol·L-1 酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体A 33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1,则气体A的成份及体积比为 。
(10分)在一次兴趣小组活动中,一小组同学利用物质间的互变,设计成一平面“魔方”如图所示。已知:

①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体,B与硝酸银溶液反应生
成不溶于稀硝酸的沉淀;B也能将一种能形成酸雨的氧化物氧化
为F,F是一种含氧酸,且F的稀溶液能与A反应生成E和G。
③几种物质的部分物理性质为:
|
物质 |
纯A(单质) |
B(溶液) |
D(固体) |
G(溶液) |
|
颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
依据以上信息填空。
(1)G生成C的过程中所出现的现象为 ;
(2)写出下列反应化学方程式:A→B: ;
(3)写出下列反应的离子方程式:B→F: ;
酸性条件下,G与次氯酸溶液反应: ;
(4)使一定质量的Zn与100ml18.5mol·L-1酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol·L-1,则气体的成分及体积比为 。