题目内容
【题目】磷酸亚铁![]() 为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产
为白蓝色晶体,溶于强酸,不溶于水和乙醇。它是生产![]() 的原料,实验室利用
的原料,实验室利用![]() 、
、![]() 及
及![]() 为原料制备磷酸亚铁的实验流程如图1:
为原料制备磷酸亚铁的实验流程如图1:
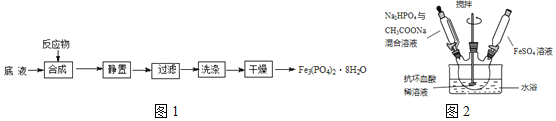
合成时的主要反应为:![]()
![]() 实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______。
实验中由原料配制溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是______。
![]() 合成时,在三口烧瓶中先加入抗坏血酸
合成时,在三口烧瓶中先加入抗坏血酸![]() 稀溶液作底液,再向烧瓶中,滴入
稀溶液作底液,再向烧瓶中,滴入![]() 与
与![]() 混合溶液至
混合溶液至![]() 时,再滴入
时,再滴入![]() 溶液,最终维持
溶液,最终维持![]() 装置如图2所示
装置如图2所示![]() 。
。
![]() 实验不是将三种溶液直接混合的原因是______。
实验不是将三种溶液直接混合的原因是______。
![]() 用抗坏血酸溶液作底液而不用铁粉,其主要原因是______。
用抗坏血酸溶液作底液而不用铁粉,其主要原因是______。
![]() 生成的
生成的![]() 沉淀需充分洗涤,检验洗涤是否完全的方法是______
沉淀需充分洗涤,检验洗涤是否完全的方法是______
![]() 检验产品中是否混有
检验产品中是否混有![]() 或
或![]() 杂质的方法是______。
杂质的方法是______。
![]() 某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠
某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠![]() 含
含![]() 、重金属盐及有色杂质等
、重金属盐及有色杂质等![]() 提纯得到
提纯得到![]() 晶体。已知:
晶体。已知:![]() 溶液pH
溶液pH![]() ,重金属硫化物不溶于水。
,重金属硫化物不溶于水。
请补充实验步骤
![]() 实验中必须使用的试剂有:
实验中必须使用的试剂有:![]() 溶液、活性炭、
溶液、活性炭、![]() 溶液、乙醇
溶液、乙醇![]() 磷酸氢二钠在水中溶解度
磷酸氢二钠在水中溶解度![]() 水
水![]()
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|
|
|
|
| |||||||
|
| ||||||||||
|
|
|
|
|
| ||||||
|
|
将工业品溶于适量热水,______。
【答案】除去其中溶解的氧气 避免生成![]() 沉淀 避免产品中混入铁粉 取最后一次的洗涤滤液
沉淀 避免产品中混入铁粉 取最后一次的洗涤滤液![]() 于试管中,向其中滴加
于试管中,向其中滴加![]() 溶液,若无白色沉淀产生,则表明已洗涤干净 取少量固体溶于适量盐酸,然后滴入KSCN溶液,溶液变红色,说明含有
溶液,若无白色沉淀产生,则表明已洗涤干净 取少量固体溶于适量盐酸,然后滴入KSCN溶液,溶液变红色,说明含有![]() ,即产品中混有
,即产品中混有![]() 或
或![]() 杂质;否则不含 逐滴滴入
杂质;否则不含 逐滴滴入![]() 溶液,至不再产生沉淀为止;加入活性炭煮沸,趁热过滤;用
溶液,至不再产生沉淀为止;加入活性炭煮沸,趁热过滤;用![]() 溶液调节溶液pH至
溶液调节溶液pH至![]() ;加热浓缩,冷却结晶,过滤;用乙醇洗涤,低温干燥
;加热浓缩,冷却结晶,过滤;用乙醇洗涤,低温干燥
【解析】
(1)由原料配制溶液时,蒸馏水事先要煮沸、冷却,可以除去溶液中的溶解的氧气,避免氧化Fe2+;
(2)①分别加入药品,混合溶液至PH=4时,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;②铁粉是固体,混在产品中;
(3)生成的Fe3(PO4)28H2O 固体混有杂质SO42-离子,通过检验SO42-,判断沉淀洗涤干净与否;
(4)通常用KSCN溶液检验Fe3+;
(5)重金属硫化物不溶于水,用过量Na2S溶液除去重金属离子,至不再生成沉淀为止;随后加入活性炭煮沸,趁热过滤;用H3PO4和NaOH溶液调节溶液pH,得到Na2HPO4溶液;然后加热浓缩,冷却结晶,过滤;最后加入乙醇,降低Na2HPO4溶解度,冷却结晶,析出晶体。
![]() 具有强还原性,由原料配制溶液时,蒸馏水事先要煮沸、冷却,可以除去溶液中的溶解的氧气,避免氧化
具有强还原性,由原料配制溶液时,蒸馏水事先要煮沸、冷却,可以除去溶液中的溶解的氧气,避免氧化![]() ;
;
![]() 实验不是将三种溶液直接混合,分别加入
实验不是将三种溶液直接混合,分别加入![]() 与
与![]() 混合溶液至
混合溶液至![]() 时,再加入
时,再加入![]() 溶液,防止三者混合时,促进相互的水解,导致亚铁离子水解生成
溶液,防止三者混合时,促进相互的水解,导致亚铁离子水解生成![]() 沉淀;
沉淀;
![]() 制备磷酸亚铁最终是固体状态,铁粉是固体极易混在产品中,故用抗坏血酸溶液作底液而不用铁粉;
制备磷酸亚铁最终是固体状态,铁粉是固体极易混在产品中,故用抗坏血酸溶液作底液而不用铁粉;
![]() 生成的
生成的![]() 固体混有杂质
固体混有杂质![]() 离子,取最后一滴洗涤滤液
离子,取最后一滴洗涤滤液![]() 于试管中,向其滴加
于试管中,向其滴加![]() 溶液,若无白色沉淀硫酸钡产生,则表明已洗涤干净;
溶液,若无白色沉淀硫酸钡产生,则表明已洗涤干净;
![]() 通常用KSCN溶液检验
通常用KSCN溶液检验![]() ,取少量固体溶于适量盐酸,然后滴入KSCN溶液,溶液变红色,说明含有
,取少量固体溶于适量盐酸,然后滴入KSCN溶液,溶液变红色,说明含有![]() ,否则不含;
,否则不含;
(5)重金属硫化物不溶于水,用过量Na2S溶液除去重金属离子,至不再生成沉淀为止;随后加入活性炭煮沸(可吸附有色杂质,起到脱色的作用),趁热过滤,“趁热过滤”可以防止冷却后晶体析出,与活性炭一起被过滤到滤纸上而损失,;已知:Na2HPO4溶液pH8.2~8.4,用0.1mol/LH3PO4和NaOH溶液调节溶液pH8.2~8.4,即得到Na2HPO4溶液;然后加热浓缩,冷却结晶,过滤;最后加入乙醇,降低Na2HPO4溶解度,冷却结晶,析出Na2HPO412H2O晶体。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。
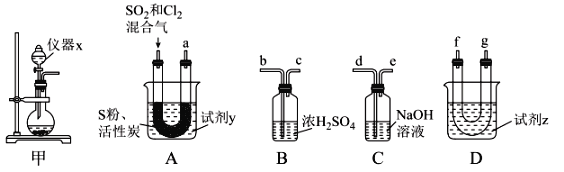
请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为____(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式)。
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0。该反应在恒容密闭容器中达到平衡后,若仅改变图中横轴x的值,纵轴y随x变化趋势合理的是( )
选项 | x | y |
A | CO的物质的量 | CO2与CO的物质的量之比 |
B | 反应温度 | 逆反应速率 |
C | 体系压强 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
A.AB.BC.CD.D