题目内容
用实验确定某酸HA是弱电解质.两同学的方案是:甲:①称取一定质量的HA配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质.
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
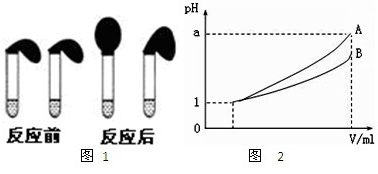
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质.
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH
乙方案中,说明HA是弱电解质的现象是
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快.
(3)甲方案的第②步中用pH试纸测定溶液pH的操作是
(4)丙同学认为乙方案中存在难以实现之处和不妥之处.难以实现之处是
(5)若该酸为醋酸,常温下用6.0g醋酸配制的溶液与 NaOH溶液完全中和时放出的热量是a kJ/mol,该反应的热化学方程式是
分析:(1)根据仪器的作用选取仪器;
(2)弱电解质部分电离,反应速率与氢离子浓度成正比,pH相等的强酸和弱酸稀释相同的倍数后,弱酸中氢离子浓度大于强酸;
(3)用滴有试液的试纸与标准比色卡对比;
(4)配制pH=l的HA溶液难以实现;实验操作中金属的表面积相同难控制;
(5)6.0g醋酸的物质的量=
=0.1mol,6.0g醋酸配制的溶液与 NaOH溶液完全中和时放出的热量是a kJ/mol,则生成1mol水放出的热量是10akJ.
(2)弱电解质部分电离,反应速率与氢离子浓度成正比,pH相等的强酸和弱酸稀释相同的倍数后,弱酸中氢离子浓度大于强酸;
(3)用滴有试液的试纸与标准比色卡对比;
(4)配制pH=l的HA溶液难以实现;实验操作中金属的表面积相同难控制;
(5)6.0g醋酸的物质的量=
| 6.0g |
| 60g/mol |
解答:解:(1)在两个方案的第①步中,都要用到的定量仪器是100mL容量瓶,故答案为:100mL容量瓶;
(2)弱电解质部分电离,则0.1mol/L的溶液中氢离子浓度小于0.1mol/L,所以pH>1,
pH相等的强弱酸中,加水稀释促进弱酸电离,导致稀释后弱酸中氢离子浓度大于强酸,氢离子浓度越大,反应速率越大,所以如果装HA溶液的试管中放出H2的速率快就证明HA为弱酸,故选b;
故答案为:>;b;
(3)pH试纸测定溶液pH的操作是:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照,
故答案为:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(4)在溶液配制过程中,加水稀释促进弱电解质电离,所以配制pH=1的溶液难以实现,
锌粒的表面积难以控制相同,
故答案为:配制pH=l的HA溶液难以实现;加入的锌粒难以做到表面积相同;
(5)6.0g醋酸的物质的量=
=0.1mol,6.0g醋酸配制的溶液与 NaOH溶液完全中和时放出的热量是a kJ/mol,则生成1mol水放出的热量是10akJ,所以其热化学方程式为:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=10a kJ?mol-1,
故答案为:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=10a kJ?mol-1.
(2)弱电解质部分电离,则0.1mol/L的溶液中氢离子浓度小于0.1mol/L,所以pH>1,
pH相等的强弱酸中,加水稀释促进弱酸电离,导致稀释后弱酸中氢离子浓度大于强酸,氢离子浓度越大,反应速率越大,所以如果装HA溶液的试管中放出H2的速率快就证明HA为弱酸,故选b;
故答案为:>;b;
(3)pH试纸测定溶液pH的操作是:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照,
故答案为:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(4)在溶液配制过程中,加水稀释促进弱电解质电离,所以配制pH=1的溶液难以实现,
锌粒的表面积难以控制相同,
故答案为:配制pH=l的HA溶液难以实现;加入的锌粒难以做到表面积相同;
(5)6.0g醋酸的物质的量=
| 6.0g |
| 60g/mol |
故答案为:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=10a kJ?mol-1.
点评:本题考查了强弱电解质的判断,明确强弱电解质划分标准是解本题关键,再结合溶液的配制、热化学方程式的书写、pH试纸的使用方法等知识点来分析解答,难度不大.

练习册系列答案
相关题目
 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下: