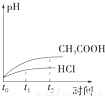
题目内容
1LpH=2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则图中比较符合客观事实的是( )
分析:n(Zn)=
=0.01mol,pH=2的盐酸中c(HCl)=0.01mol/L,1LpH=2的盐酸中n(HCl)=0.01mol/L×1L=0.01mol,醋酸是弱电解质,所以pH为2的醋酸和盐酸,醋酸的浓度大于0.01mol/L,所以pH为2体积为1L的醋酸溶液中醋酸的物质的量大于0.01mol,Zn+2HCl=ZnCl2+H2↑,根据方程式知,锌有剩余,醋酸生成的氢气大于盐酸.
| 0.65g |
| 65g/mol |
解答:解:A.HCl是强电解质,醋酸是弱电解质,随着反应的进行醋酸电离出氢离子,导致反应过程中醋酸中氢离子浓度大于盐酸,所以pH:HCl>CH3COOH,故A正确;
B.反应速率与氢离子浓度成正比,HCl是强电解质,醋酸是弱电解质,随着反应的进行醋酸电离出氢离子,导致反应过程中醋酸中氢离子浓度大于盐酸,所以CH3COOH反应速率大于HCl,故B错误;
C.pH=2的醋酸和盐酸,c(CH3COOH)>c(HCl)=0.01mol/L,所以1LpH=2的醋酸和盐酸中,n(CH3COOH)>n(HCl)=0.01mol,n(Zn)=
=0.01mol,根据Zn+2HCl=ZnCl2+H2↑知,锌有剩余,醋酸的物质的量大,则醋酸生成的氢气体积大,且醋酸的反应速率大于盐酸,则醋酸反应完全时所用时间较短,故C正确;
D.反应过程中,醋酸电离出氢离子导致醋酸溶液中氢离子浓度大于盐酸,故D错误;
故选AC.
B.反应速率与氢离子浓度成正比,HCl是强电解质,醋酸是弱电解质,随着反应的进行醋酸电离出氢离子,导致反应过程中醋酸中氢离子浓度大于盐酸,所以CH3COOH反应速率大于HCl,故B错误;
C.pH=2的醋酸和盐酸,c(CH3COOH)>c(HCl)=0.01mol/L,所以1LpH=2的醋酸和盐酸中,n(CH3COOH)>n(HCl)=0.01mol,n(Zn)=
| 0.65g |
| 65g/mol |
D.反应过程中,醋酸电离出氢离子导致醋酸溶液中氢离子浓度大于盐酸,故D错误;
故选AC.
点评:本题考查了化学反应速率的影响条件、弱电解质的电离平衡的应用、图象分析方法,根据弱电解质的电离特点、影响反应速率的因素等来分析解答,注意要进行过量计算,为易错点.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目