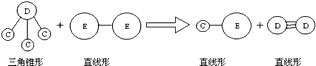
��Ŀ����
����Ŀ��ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飺
��1���ٽ��ơ��ء�þ������1 mol�ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ�����������ᷴӦ����ң������ᷴӦ���ٶ������������ᷴӦ������������࣮
����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ ��
��2������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯���� 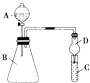
������B������Ϊ �� �����D������Ϊ��ֹ ��
����Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ�� �ᣬB�м�KMnO4 �� ��KMnO4��Ũ���᳣���·�Ӧ������������C�мӵ��۵⻯�ػ����Һ���۲쵽C��Һ������Ϊ �� ����֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�������Һ����β��
���𰸡�
��1���أ���������S2��+Cl2�TS��+2Cl��
��2����ƿ��������������NaOH
���������⣺��1����Na��Kͬ���壬K�Ľ����Ա�Na��ǿ���ơ�þ����Ϊͬ���ڽ���Ԫ�أ����������μ������ʼ������ᷴӦ����ң��������ᷴӦ��������ݵ�ʧ�����غ㣬ʧȥ�ĵ�����Խ�࣬����������Խ�࣬���������ᷴӦ���ɵ�������࣬���Դ��ǣ��أ�������������������ǿ�����ԣ�������Na2S��Ӧ����NaCl�͵��������ӷ���ʽΪ��S2��+Cl2�TS��+2Cl�� �� ���Դ��ǣ�S2��+Cl2�TS��+2Cl������2����B������������ƿ��������ϲ��ռ���л������ã��ܷ�ֹ�����������Դ��ǣ���ƿ����������KMnO4��Ũ���ᷴӦ������������������۵⻯�ػ����Һ��Ӧ���ɵⵥ�ʣ�����������Һ����ɫ������������������������������������ԣ��������⣬��ǽ����ԣ�Cl��I����������������ɢ�������У���Ⱦ���������ü�Һ���գ����Դ��ǣ�������NaOH��

 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д� ״Ԫ����ϵ�д�
״Ԫ����ϵ�д�����Ŀ��ijʵ��С��ͬѧΪ��̽��ͭ��Ũ����ķ�Ӧ������������ʵ�飬ʵ��װ����ͼ��ʾ��

ʵ�鲽�裺
����������ͼ��ʾ��װ�ã����������ԣ��ټ����Լ���
������A�Թܣ���B�Թ���Ʒ����Һ��ɫ��Ϩ��ƾ��ƣ�
����Cu˿���ϳ鶯�뿪Һ�档
��ش��������⣺
(1)A�Թ��з�����Ӧ�Ļ�ѧ����ʽΪ ��
(2)�ܹ�֤��ͭ��Ũ���ᷴӦ���������ʵ�������� ��
(3)��ʢ��BaCl2��Һ��C�Թ��У����˵��ܿ��������⣬���������������������е���Һ�ֳ����ݣ��ֱ�μ�������Һ�������������Ļ�ѧʽ������ж�Ӧ��λ�á�
�μӵ���Һ | ��ˮ | ��ˮ |
�����Ļ�ѧʽ |
д������SO2���ֻ�ԭ�Ե����ӷ�Ӧ����ʽ�� ��
(4)ʵ����Ϻ���Ϩ��ƾ��ƣ����ڵ���E�Ĵ��ڣ��Թ�B�е�Һ�岻�ᵹ�����Թ�A�У���ԭ���� ��
(5)ʵ����Ϻ�װ���в����������ж������ܴ����ϵĽ�����Ϊ�˷�ֹ�����������������Ⱦ���������װ��ǰ��Ӧ����ȡ�IJ����� ��
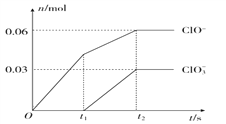
(6)��SO2����ͨ�뺬��n mol Na2S����Һ�У���ַ�Ӧ����Һ�г��ֻ�ɫ���ǣ��Է�������Һ���������SO2���� mol(�������ܽ��SO2)��