题目内容
【题目】工业上硫化碱法制备Na2S2O2的原理是2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应的△H<0),某研究小组在实验室用此法制备Na2S2O2的装置与步骤如下,请回答有关问题:
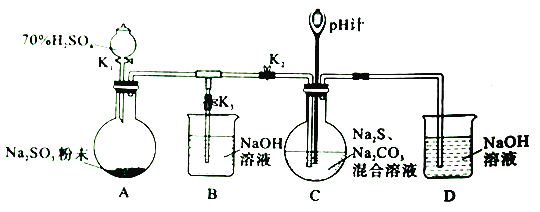
I、制备Na2S2O2实验步骤如下:
步骤1:先组装仪器,然后________。
步骤2:添加药品。关闭K1、K2、K3按图中所示依固体、溶液顺序将所需药品加入各仪器。
步骤3:打开K2,关闭K3,调节K1,使硫酸缓慢匀速滴下,导管口有气泡冒出,pH计读数逐渐减小。当pH计读数接近7时,打开K3,关闭K1、K2。
步骤4:将C中所得溶液加热浓缩,冷却析出Na2S2O2,经过滤、洗涤、干燥,得到产品。
(1)步骤1中缺少的操作是___________。
(2)装置A中发生反应的化学方程式为___________。
(3)为了使SO2尽可能被吸收完全,在不改变装置C中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可以采取的措施有________(任写一条)。
(4)装置C中Na2S和Na2CO3的物质的量浓度之比约为2:1,若Na2S过量则C中会出现淡黄色的浑浊,用离子方程式解释其原因为____________。
(5)实验制得的Na2S2O3产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论_____________。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用浓度为0.1000mol/L碘的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-
(6)滴定至终点时的现象为____________。
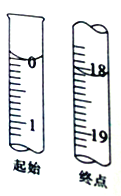
(7)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL,计算所得样品的纯度为_________(用含W的代数式表示)。
【答案】 检查装置气密性 H2SO4(浓) + Na2SO3=SO2↑ + H2O + Na2SO4 增加SO2的接触面积、控制SO2的流速、适当升高温度 2S2-+3SO2![]() 3S↓+2SO32-(或2S2-+5SO2+ 2H2O
3S↓+2SO32-(或2S2-+5SO2+ 2H2O![]() 3S↓+4HSO3-) 取少量产品于试管中,先滴加过量的稀盐酸,静置后取上层清液(或过滤后取滤液)少许,再滴加氯化钡溶液,若出现白色沉淀,说明产品中含有Na2SO4杂质;若无白色沉淀产生,说明产品中不存在Na2SO4杂质 当最后一滴碘的标准溶液滴下时,混合液由无色变为蓝色,且半分钟内颜色保持不变 18.10
3S↓+4HSO3-) 取少量产品于试管中,先滴加过量的稀盐酸,静置后取上层清液(或过滤后取滤液)少许,再滴加氯化钡溶液,若出现白色沉淀,说明产品中含有Na2SO4杂质;若无白色沉淀产生,说明产品中不存在Na2SO4杂质 当最后一滴碘的标准溶液滴下时,混合液由无色变为蓝色,且半分钟内颜色保持不变 18.10 ![]() %
%
【解析】(1)为确保实验的顺利进行,步骤1中缺少的操作是检查装置气密性;(2)装置A制备二氧化硫,发生反应的化学方程式为H2SO4(浓) + Na2SO3=![]() SO2↑ + H2O + Na2SO4 ;(3).为了使SO2尽可能被吸收完全,可以增加SO2的接触面积、控制SO2的流速、适当升高温度(任写一条即可);(4)若Na2S过量则C中会出现淡黄色的浑浊,-2价的硫具有还原性,被SO2氧化,用离子方程式解释其原因为2S2-+3SO2
SO2↑ + H2O + Na2SO4 ;(3).为了使SO2尽可能被吸收完全,可以增加SO2的接触面积、控制SO2的流速、适当升高温度(任写一条即可);(4)若Na2S过量则C中会出现淡黄色的浑浊,-2价的硫具有还原性,被SO2氧化,用离子方程式解释其原因为2S2-+3SO2![]() 3S↓+2SO32-(或2S2-+5SO2+ 2H2O
3S↓+2SO32-(或2S2-+5SO2+ 2H2O![]() 3S↓+4HSO3-);(5)检测Na2S2O3产品中是否存在Na2SO4杂质,要先除去Na2S2O3,再检验硫酸根离子,实验操作、现象和结论为:取少量产品于试管中,先滴加过量的稀盐酸,静置后取上层清液(或过滤后取滤液)少许,再滴加氯化钡溶液,若出现白色沉淀,说明产品中含有Na2SO4杂质;若无白色沉淀产生,说明产品中不存在Na2SO4杂质。(6)滴定至终点时的现象为当最后一滴碘的标准溶液滴下时,混合液由无色变为蓝色,且半分钟内颜色保持不变。(7)由图滴定起始和终点的液面位置,则消耗碘的标准溶液体积为18.10mL-0.00mL=18.10mL,根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以W g产品中含有Na2S2O3,质量为:0.1000 mol·L-1×18.10×10-3L×2×158g·mol-1=0.572g,则产品的纯度为:0.572g/Wg×100%=
3S↓+4HSO3-);(5)检测Na2S2O3产品中是否存在Na2SO4杂质,要先除去Na2S2O3,再检验硫酸根离子,实验操作、现象和结论为:取少量产品于试管中,先滴加过量的稀盐酸,静置后取上层清液(或过滤后取滤液)少许,再滴加氯化钡溶液,若出现白色沉淀,说明产品中含有Na2SO4杂质;若无白色沉淀产生,说明产品中不存在Na2SO4杂质。(6)滴定至终点时的现象为当最后一滴碘的标准溶液滴下时,混合液由无色变为蓝色,且半分钟内颜色保持不变。(7)由图滴定起始和终点的液面位置,则消耗碘的标准溶液体积为18.10mL-0.00mL=18.10mL,根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以W g产品中含有Na2S2O3,质量为:0.1000 mol·L-1×18.10×10-3L×2×158g·mol-1=0.572g,则产品的纯度为:0.572g/Wg×100%=![]() %。
%。

 智慧小复习系列答案
智慧小复习系列答案