题目内容
99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是( )
| A、此时水的离子积Kw=1×10-12 |
| B、水电离出的c(H+)=1×10-12mol/L |
| C、水的电离程度随温度升高而增大 |
| D、c(Na+)>c(SO42-) |
考点:水的电离,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A、计算出pH=6的蒸馏水中氢离子浓度,根据水的离子积表达式及蒸馏水中c(H+)=c(OH-)计算出水的离子积;
B、硫酸氢钠电离的氢离子抑制了水的电离,溶液中氢氧根离子是水电离的;
C、水的电离是吸热反应,温度升高,水的电离程度增大;
D、根据物料守恒判断钠离子与硫酸根离子浓度关系.
B、硫酸氢钠电离的氢离子抑制了水的电离,溶液中氢氧根离子是水电离的;
C、水的电离是吸热反应,温度升高,水的电离程度增大;
D、根据物料守恒判断钠离子与硫酸根离子浓度关系.
解答:
解:A、蒸馏水的pH=6,说明c(H+)=c(OH-)=1×10-6mol?L-1,水的离子积Kw=1×10-12,故A正确;
B、水电离出来的氢离子的浓度等于溶液中氢氧根的浓度,c(H+)=c(OH-)=
mol/L=1×10-10mol?L-1,故B错误;
C、由于水的电离过程为吸热反应,升高温度,促进了水的电离,水的电离程度会增大,故C正确;
D、NaHSO4晶体中钠离子与硫酸根离子的物质的量相等,钠离子和硫酸根离子数目没有发生变化,根据物料守恒,溶液中(Na+)=c(SO42-),故D错误;
故选BD.
B、水电离出来的氢离子的浓度等于溶液中氢氧根的浓度,c(H+)=c(OH-)=
| 1×10-12 |
| 0.01 |
C、由于水的电离过程为吸热反应,升高温度,促进了水的电离,水的电离程度会增大,故C正确;
D、NaHSO4晶体中钠离子与硫酸根离子的物质的量相等,钠离子和硫酸根离子数目没有发生变化,根据物料守恒,溶液中(Na+)=c(SO42-),故D错误;
故选BD.
点评:本题考查了水的电离,题目难度中等,注意水的离子积常数与溶液的温度有关,明确影响水的电离的因素即可解答,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
相关题目
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是( )
| A、在含等物质的量的Ba(OH)2、KOH的混合溶液中缓慢通入CO2:Ba(OH)2、KOH、K2CO3、BaCO3 |
| B、在含等物质的量的FeBr2、FeI2的溶液中缓慢通入氯气:I-、Fe2+、Br- |
| C、在含等物质的量的[Al(OH)4]-、OH-、CO32-的溶液中逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO32- |
| D、在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
下列说法不正确的是( )
| A、2,5-二甲基-3-乙基己烷的实验式:C5H11 |
B、芳香烃M的结构模型为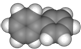 ,则M的结构简式为 ,则M的结构简式为  |
| C、纤维素三硝酸酯的分子式为(C6H7N3O11)n |
D、有机物 中所有原子有可能都在同一平面上 中所有原子有可能都在同一平面上 |
 如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触,而稀硫酸又不够了.为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触,而稀硫酸又不够了.为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液 ④醋酸钠溶液 ⑤苯 ⑥浓氨水.
| A、①②④ | B、②⑤⑥ |
| C、③④⑤ | D、①③④ |
能够增加反应物分子中活化分子百分数的措施是( )
| A、升高温度 | B、减小压强 |
| C、增大压强 | D、增大浓度 |
以下原子能产生发射光谱的是( )
| A、1s22s1 |
| B、1s22s22p1 |
| C、1s22s12p2 |
| D、1s22s22p3 |
现有三组溶液(1)汽油和氯化钠溶液; (2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液.以上混合溶液分离的正确方法依次是( )
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、萃取、分液 |
塑料的使用大大方便了人类的生活,但由此也带来了严重的“白色污染”.下列对废弃塑料制品的处理方法中最为恰当的是( )
| A、焚烧 |
| B、粉碎后深埋 |
| C、倾倒在海洋中 |
| D、用化学方法加工成防水涂料或汽油 |
