��Ŀ����
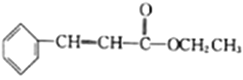
����Ŀ����ij���º����ܱ������г���0.2 mol X���������·�Ӧ��2X(g)![]() Y(g)+3Z(g) ��H��a kJ��mol-1(a>0)������˵����ȷ����
Y(g)+3Z(g) ��H��a kJ��mol-1(a>0)������˵����ȷ����
A. ����X��Ũ�ȣ�����Ӧ���������淴Ӧ���ʼ�С
B. �����������ܶȲ��ٱ仯ʱ���÷�Ӧ�ﵽ��ѧƽ��״̬
C. �ﵽ��ѧƽ��״̬ʱ�������� 0.1a kJ������
D. ��ƽ�������Ӧ���г��� 0.2 mol X����ƽ���X��ת���ʼ�С
���𰸡�D
��������A������X��Ũ�ȣ�����Ӧ�������ı��˲�䣬�������Ũ�Ȳ��䣬�淴Ӧ���ʲ��䣬���ŷ�Ӧ���У��淴Ӧ��������A����B�������ܶȵĶ��壬��ֶ������壬�����������������䣬����Ϊ����״̬��������������䣬����ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬��B����C���˷�Ӧ�ǿ��淴Ӧ��������Ŀ��Ϣ������������յ���������C����D���ٳ���0.2molX���൱����ԭ���Ļ���������ѹǿ����X��ת���ʼ�С����D��ȷ��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ������������������Һ���й���������ȷ����
��� | �� | �� | �� | �� |
pH | 11 | 11 | 3 | 3 |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
A. �ۢ��зֱ���������Ĵ����ƾ��������Һ��pH������
B. �ڢ�����Һ�������ϣ�������Һ��c��H+��>c��OH-��
C. �ֱ��ˮϡ��10����������Һ��pH����>��>��>��
D. �������Һ�У�ˮ�ĵ���̶ȣ���>��