题目内容
【题目】如图为实验室中浓硫酸试剂瓶标签上的部分内容,请回答问题。
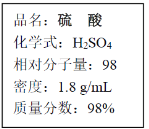
(1)该硫酸的物质的量浓度是________mol/L。
(2)某实验需要90mL3.0mol/L稀硫酸,配制该溶液,经计算,需要用量筒量取___mL浓硫酸。
(3)在下列配制过程示意图中,有错误的是(填写序号)________。

(4)下列情况会引起所配稀硫酸浓度偏高的是________。
A 用蒸馏水将量筒中残留的硫酸洗出合并 B 容量瓶洗涤后,未经干燥处理
C 溶液未能冷却就定容 D 未洗涤烧杯和玻璃棒
【答案】18 16.7 ①④ AC
【解析】
(1)根据c=![]() 带入数据进行计算;
带入数据进行计算;
(2)根据溶液稀释前后物质的量不变计算所需浓硫酸的体积,没有90mL的容量瓶,以100mL容量瓶计算;
(3)根据正确配制一定物质的量浓度的溶液操作步骤进行分析;
(4)根据c= ![]() 进行误差分析。
进行误差分析。
(1)根据c=![]() ,该浓硫酸的物质的量浓度为:c=
,该浓硫酸的物质的量浓度为:c=![]() mol·L-1=18.0mol·L-1。
mol·L-1=18.0mol·L-1。
(2)根据溶液稀释前后物质的量不变计算所需浓硫酸的体积,没有90mL的容量瓶,以100mL计算,设浓硫酸的体积为xmL,所以xmL×18.0mol·L-1=100mL×3mol·L-1,解得:x≈16.7;
(3)①应将浓硫酸倒入水;②引流操作正确;③用玻璃棒引流,操作正确;④读数时视线与凹液面最低处相切,故选①④。
(4)A、用蒸馏水将量筒中残留的硫酸洗出合并,取浓硫酸的体积增大,所配溶液浓度偏高,故A正确;
B、最后需要加水定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,故B错误;
C、溶液有热胀冷缩的性质,浓硫酸稀释,放出大量的热,溶解后未恢复室温立即转移到容量瓶中定容,导致所配溶液体积减小,所配溶液浓度偏高,故C正确;
D、未洗涤烧杯和玻璃棒,移入容量瓶中的溶质硫酸的物质的量减小,所配溶液浓度偏低,故D错误;
故选AC。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案