题目内容
把2.3g钠放入100mL 0.1mol/L AlCl3溶液中,待其充分反应后,下列叙述中错误的是
- A.Cl-的浓度几乎不变
- B.溶液变浑浊
- C.溶液中Al3+全部转化为AlO
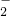
- D.溶液中存在最多的离子是Cl-
BD
分析:先根据钠与水发生反应2Na+2H2O=2NaOH+H2↑,计算生成的氢氧化钠,再根据氢氧化钠与氯化铝的物质的量判断Al3+与OH-发生的反应,结合选项判断.
解答:2.3g钠的物质的量为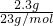 =0.1mol,由反应2Na+2H2O=2NaOH+H2↑可知生成氢氧化钠0.1mol,AlCl3的物质的量为0.1L×0.1mol?L-1=0.01mol,n(Al3+):n(OH-)=0.01mol:0.1mol=1:10,所以Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,
=0.1mol,由反应2Na+2H2O=2NaOH+H2↑可知生成氢氧化钠0.1mol,AlCl3的物质的量为0.1L×0.1mol?L-1=0.01mol,n(Al3+):n(OH-)=0.01mol:0.1mol=1:10,所以Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,
A、参加反应的水很小,溶液的体积变化不大,氯离子不反应,Cl-的浓度几乎不变,故A正确;
B、Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,溶液澄清,故B错误;
C、Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,溶液中Al3+全部转化为AlO2-,故C正确;
D、溶液中Na+为0.2mol,Cl-为0.06mol,AlO2-为0.02mol,OH-为0.2mol-0.02mol×4=0.12mol,溶液中存在最多的离子是Na+,故D错误;
故选BD.
点评:本题考查钠铝及其化合物的性质、化学计算等,判断氢氧化钠与氯化铝的反应是解题关键.
分析:先根据钠与水发生反应2Na+2H2O=2NaOH+H2↑,计算生成的氢氧化钠,再根据氢氧化钠与氯化铝的物质的量判断Al3+与OH-发生的反应,结合选项判断.
解答:2.3g钠的物质的量为
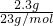 =0.1mol,由反应2Na+2H2O=2NaOH+H2↑可知生成氢氧化钠0.1mol,AlCl3的物质的量为0.1L×0.1mol?L-1=0.01mol,n(Al3+):n(OH-)=0.01mol:0.1mol=1:10,所以Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,
=0.1mol,由反应2Na+2H2O=2NaOH+H2↑可知生成氢氧化钠0.1mol,AlCl3的物质的量为0.1L×0.1mol?L-1=0.01mol,n(Al3+):n(OH-)=0.01mol:0.1mol=1:10,所以Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,A、参加反应的水很小,溶液的体积变化不大,氯离子不反应,Cl-的浓度几乎不变,故A正确;
B、Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,溶液澄清,故B错误;
C、Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,溶液中Al3+全部转化为AlO2-,故C正确;
D、溶液中Na+为0.2mol,Cl-为0.06mol,AlO2-为0.02mol,OH-为0.2mol-0.02mol×4=0.12mol,溶液中存在最多的离子是Na+,故D错误;
故选BD.
点评:本题考查钠铝及其化合物的性质、化学计算等,判断氢氧化钠与氯化铝的反应是解题关键.

练习册系列答案
相关题目
下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | NH3的水溶液可以导电 | NH3是电解质 |
| B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色 | BaCl2溶液有酸性 |
| C | Na2SiO3溶液中通入CO2产生白色沉淀 | 酸性:H2CO3>H2SiO3 |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
- A.A
- B.B
- C.C
- D.D
 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
