题目内容
10.下列各装置中,能构成原电池的是( )| A. |  盐酸 | B. |  稀硫酸 | ||
| C. |  乙醇 | D. |  稀硫酸 |
分析 构成原电池需具备以下条件:两个活性不同的电极;电解质溶液;形成闭合回路;存在能自动发生的氧化还原反应,且为放热反应,以此来解答.
解答 解:原电池的构成条件是:1、有两个活泼性不同的电极,2、将电极插入电解质溶液中,3、两电极间构成闭合回路,4、能自发的进行氧化还原反应,
A、符合构成原电池的条件,且铁与盐酸可自发的氧化还原反应,故A正确;
B、电极相同都是铁,不具备构成原电池的条件,故B错误;
C、乙醇是非电解质,故C错误;
D、没有形成闭合回路,故D错误;
故选A.
点评 本题考查了原电池原理的分析应用,该题是高考中的常见考点,属于基础性试题的考查,难度不大.明确原电池的工作原理、构成条件是答题的关键.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 相对分子质量相同的物质是同种物质 | |
| B. | 分子式相同的不同有有机物一定是同分异构体 | |
| C. | 具有同一通式的物质属于同系物 | |
| D. | 分子中含有碳和氢的化合物是烃类 |
1.决定化学反应速率的决定因素是( )
| A. | 反应物本身的性质 | B. | 催化剂 | ||
| C. | 反应物的浓度 | D. | 压强 |
18.下列分子属于极性分子的是( )
| A. | NH3 | B. | CO2 | C. | H2 | D. | Cl2 |
5.某物质灼烧时,焰色反应为黄色,则下列判断不正确的是( )
| A. | 该物质可能是钠的化合物 | B. | 该物质一定含钠元素 | ||
| C. | 不能确定该物质中是否含有钾元素 | D. | 该物质一定是金属钠 |
2.在可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)中,改变下列条件,不能使速率增大的是( )
| A. | 升高温度 | B. | 降低温度 | C. | 使用催化剂 | D. | 增大反应物浓度 |
19.从下列事实所得出的相应结论正确的是( )
| 实验事实 | 结论或原因 | |
| A | SO2的水溶液可以导电 | SO2是电解质 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的Ca(ClO)2与空气中的CO2反应生成CaCO3和见光易分解的HClO |
| C | 石灰石与二氧化硅在高温下反应可制得硅酸钙 | 非金属性:Si>C |
| D | 碳酸氢钠可用作食品的膨松剂 | 碳酸氢钠能与碱反应 |
| A. | A | B. | B | C. | C | D. | D |

 A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题:
A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题: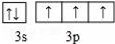 .
.