题目内容
电解饱和食盐水可生产氯气,氢气和氢氧化钠,氯气与石灰乳反应可制得漂白粉.(1)请写出上述过程中发生反应的化学方程式
(2)若电解饱和食盐水时消耗NaCl 117g,试计算理论上最多可得到氯气的体积(标准状况)
(3)若将2mol氯气通入足量石灰乳中,理论上可得到次氯酸钙多少克?
【答案】分析:依据电解反应的化学方程式和电极反应,结合电解过程中电子守恒计算,化学方程式的计算.
解答:解:(1)电解饱和食盐水发生的反应为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,氯气可以和氢氧化钙发生反应生成氯化钙、次氯酸钙和水,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
2NaOH+H2↑+Cl2↑,氯气可以和氢氧化钙发生反应生成氯化钙、次氯酸钙和水,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)若电解饱和食盐水时消耗NaCl117g,反应的氯化钠物质的量=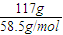 =2mol,依据化学方程式计算得到:氯气物质的量为1mol,标准状况下氯气体积为22.4L;
=2mol,依据化学方程式计算得到:氯气物质的量为1mol,标准状况下氯气体积为22.4L;
答:理论上最多可得到氯气的体积是22.4L;
(2)若将2mol氯气通入足量石灰乳中发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;2molCl2完全反应生成次氯酸钙物质的量为1mol,则次氯酸钙质量=1mol×143g/mol=143g;
答:理论上可得到次氯酸钙143克.
点评:本题考查了电解食盐水的原理应用,氯气性质的应用,化学方程式的计算方法,质量和物质的量的换算计算,气体摩尔体积的换算应用,题目简单.
解答:解:(1)电解饱和食盐水发生的反应为:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑,氯气可以和氢氧化钙发生反应生成氯化钙、次氯酸钙和水,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
2NaOH+H2↑+Cl2↑,氯气可以和氢氧化钙发生反应生成氯化钙、次氯酸钙和水,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;(2)若电解饱和食盐水时消耗NaCl117g,反应的氯化钠物质的量=
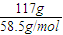 =2mol,依据化学方程式计算得到:氯气物质的量为1mol,标准状况下氯气体积为22.4L;
=2mol,依据化学方程式计算得到:氯气物质的量为1mol,标准状况下氯气体积为22.4L;答:理论上最多可得到氯气的体积是22.4L;
(2)若将2mol氯气通入足量石灰乳中发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;2molCl2完全反应生成次氯酸钙物质的量为1mol,则次氯酸钙质量=1mol×143g/mol=143g;
答:理论上可得到次氯酸钙143克.
点评:本题考查了电解食盐水的原理应用,氯气性质的应用,化学方程式的计算方法,质量和物质的量的换算计算,气体摩尔体积的换算应用,题目简单.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目


 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.