题目内容
准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度的硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如下图所示.请填空回答:
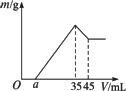
(1)H2SO4溶液的物质的量浓度为________.
(2)若a=2.3,用于沉淀Fe3+,消耗NaOH的体积是________mL,铝土矿中各组成成分的质量分数:Al2O3________,Fe2O3________,SiO2________.
(3)a值的范围应是________,在这个范围内,a值越大,________的质量分数越小.
解析:
|
答案:(1)1.75 mol·L-1 (2)2.7 85% 12% 3% (3)1.625<a<5 Fe2O3 解析:弄清楚35 mL、45 mL时沉淀的组成和质量,0到35 mL时沉淀量增多,沉淀中有Al(OH)3和Fe(OH)3,35 mL到45 mL时,Al(OH)3溶解,45 mL时沉淀仅剩Fe(OH)3. (1)35 mL时,沉淀最多,溶液为Na2SO4溶液,据电荷守恒,n(Na+)=2n( (NaOH)=10 mol·L-1×0.035 L=0.35 mol,n( (2)沉淀Al3+所耗OH-的量,是使Al(OH)3溶解所耗OH-的3倍,即沉淀Al3+所耗NaOH溶液为30 mL. n(Al2O3)= w(Al2O3)= 其他分析略去. |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案



