题目内容
11.写出铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑将足量的浓硫酸加入16g铜粉中,计算:(1)生成的二氧化硫在标准状况下的体积
(2)被还原的硫酸的质量.
分析 发生反应:反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,根据方程式计算生成二氧化硫的物质的量,根据V=nVm计算二氧化硫的体积,被还原的硫酸生成二氧化硫,根据硫原子守恒计算被还原硫酸的物质的量,再根据m=nM计算被还原硫酸的质量.
解答 解:在加热条件下,Cu和浓硫酸发生氧化还原反应生成CuSO4、H2O和SO2,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
16gCu的物质的量为$\frac{16g}{64g/mol}$=0.25mol,
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑
1 1
0.25mol 0.25mol
(1)标况下,生成V(SO2)=0.25mol×22.4L/mol=5.6L,
答:生成的二氧化硫在标准状况下的体积为5.6L;
(2)被还原的硫酸生成二氧化硫,根据硫原子守恒,被还原硫酸的物质的量为0.25mol,则被还原硫酸的质量为0.25mol×98g/mol=24.5g,
答:被还原的硫酸的质量为24.5g.
点评 本题考查化学方程式计算、氧化还原反应计算,难度不大,注意根据化合价变化理解氧化还原反应基本概念.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
7.下列表达式错误的是( )
| A. | 碳-12原子表示为${\;}_{6}^{12}$C | |
| B. | 氮原子的L层电子的电子排布图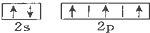 | |
| C. | 硫离子的核外电子排布式1s22s22p63s23p6 | |
| D. | NH4Cl的电子式为: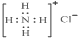 |
16. 已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).
已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).
根据实验数据求:
(1)实验完毕后,生成物中水的质量为1.8 g.假设广口瓶里生成一种正盐,其质量为5.0 g.
(2)生成的水中氢元素的质量为0.2 g.
(3)生成的CO2中碳元素的质量为0.6 g.
(4)气态化石燃料中碳元素与氢元素的质量比为3:1.
 已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).
已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
(1)实验完毕后,生成物中水的质量为1.8 g.假设广口瓶里生成一种正盐,其质量为5.0 g.
(2)生成的水中氢元素的质量为0.2 g.
(3)生成的CO2中碳元素的质量为0.6 g.
(4)气态化石燃料中碳元素与氢元素的质量比为3:1.
3.氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
| A. | 分散质粒子直径都在10-9~10-7m之间 | |
| B. | 都能产生丁达尔效应 | |
| C. | 它们都属于混合物 | |
| D. | 颜色相同 |
20.(1)短周期元素中原子核外p轨道上电子数与s轨道上电子总数相等的元素是O、Mg(写元素符号).
(2)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(3)H2S和H2O2的主要物理性质如表所示:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子之间会形成氢键,熔沸点高,H2O2与水分子之间会形成氢键,溶解度大.
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为CN-或C22-(写出一个即可).
(5)已知CrO5中Cr为+6价,则CrO5的结构式为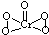 .
.
(2)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(3)H2S和H2O2的主要物理性质如表所示:
| 熔点/K | 沸点/K | 水中的溶解度(标准状况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为CN-或C22-(写出一个即可).
(5)已知CrO5中Cr为+6价,则CrO5的结构式为
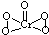 .
. 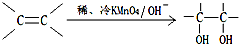 ).在下列转化关系中,P为高分子化合物.
).在下列转化关系中,P为高分子化合物.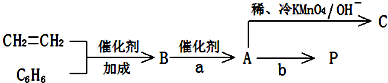
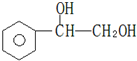 ,C与足量醋酸反应的化学方程式为
,C与足量醋酸反应的化学方程式为 ;
;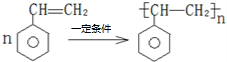 .
.