题目内容
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是
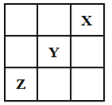
A. Y的氢化物稳定性大于Z的氢化物稳定性
B. Z一定是活泼的金属元素
C. Y的最高价氧化物的水化物是一种强酸
D. 1molX的单质可以跟足量水反应,转移的电子为2mol
【答案】A
【解析】试题分析:由短周期元素在周期表中的位置可知,X最外层电子数为2,应为He元素,Y为F元素,Z为S元素,A.Y为F元素,在周期表中是非金属性最强的元素,则Y的氢化物稳定性大于Z的氢化物稳定性,A项正确;B.Z为S元素,属于非金属元素,B项错误;C.Y为F,F的非金属性最强,F没有正价,即没有对应的含氧酸,C项错误;D.X为He元素,性质稳定,不与水反应,D项错误;答案选A。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目