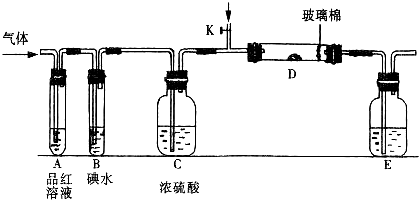
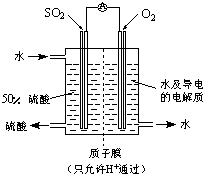
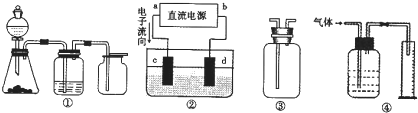
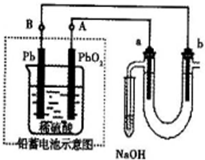
题目内容
关于如图所示各装置图的叙述不正确的是( )

分析:A.电解精炼铜时,粗铜作阳极,纯铜作阴极;
B.该装置是原电池,锌作负极,铜作正极,原电池放电时,盐桥中阴离子向负极移动;
C.金属的腐蚀与防护中,被保护的金属应该与电源的负极相连;
D.升高温度,可逆反应中化学平衡向吸热反应方向移动,降低温度,平衡向放热方向移动.
B.该装置是原电池,锌作负极,铜作正极,原电池放电时,盐桥中阴离子向负极移动;
C.金属的腐蚀与防护中,被保护的金属应该与电源的负极相连;
D.升高温度,可逆反应中化学平衡向吸热反应方向移动,降低温度,平衡向放热方向移动.
解答:解:A.根据电流方向知,a是电解池阳极,b是电解池阴极,用装置①精炼铜,粗铜作阳极,纯铜作阴极,电解质溶液是含有铜离子的可溶性盐溶液,所以a极为粗铜,电解质溶液为硫酸铜溶液,故A正确;
B.该装置是原电池,锌作负极,铜作正极,放电时,盐桥中氯离子向甲杯移动,故B错误;
C.电解池的负极上电解质溶液中阴离子导电,所以阴极金属被保护,则为了保护金属不被腐蚀,被保护的金属应该与电源的负极相连,故C正确;
D.温度对可逆反应有影响,升高温度,可逆反应中化学平衡向吸热反应方向移动,降低温度,平衡向放热方向移动,该装置中左右烧杯中温度不同,且反应体系是同一体系,所以能验证温度对化学平衡的影响,故D正确;
故选B.
B.该装置是原电池,锌作负极,铜作正极,放电时,盐桥中氯离子向甲杯移动,故B错误;
C.电解池的负极上电解质溶液中阴离子导电,所以阴极金属被保护,则为了保护金属不被腐蚀,被保护的金属应该与电源的负极相连,故C正确;
D.温度对可逆反应有影响,升高温度,可逆反应中化学平衡向吸热反应方向移动,降低温度,平衡向放热方向移动,该装置中左右烧杯中温度不同,且反应体系是同一体系,所以能验证温度对化学平衡的影响,故D正确;
故选B.
点评:不同考查原电池和电解池原理、温度对化学平衡的影响等知识点,注意原电池放电时,阴阳离子的移动方向,为易错点.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
关于如图所示各装置的叙述中,不正确的是( )


| A、装置④可用于干燥、收集氨气,并吸收多余的氨气 | B、装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO、NO2等气体 | C、装置①中,d为阳极、c为阴极 | D、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
 (2012?丹东模拟)关于如图所示各装置的叙述中,正确的是( )
(2012?丹东模拟)关于如图所示各装置的叙述中,正确的是( )