题目内容
6.(1)工业合成氨与制备HNO3一般可连续生产,其流程如下:
①写出工业合成氨的化学方程式N2+3H2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$2NH3,上述尾气中的NO2一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为6NO2+8NH3═7N2+12H2O.
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有蒸馏烧瓶、温度计、冷凝管.
(2)合成氨用的 H2 可以甲烷为原料制得.已知
CO(g)+$\frac{1}{2}$O2 (g)═CO2 (g)△H=-282kJ•mo-1 ①
H2 (g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mo-1 ②
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-846.3kJ•mo-1 ③.
则 CH4 (g)与 H2O(g)反应生成CO(g)和 H2 (g)的热化学方程式为CH4(g)+H2O(g)═CO(g)+3H2(g)△H=-322.5kJ•mo-1.
分析 (1)①工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,NO一定条件下可与氨气反应转化为氮气,结合原子守恒配平书写得到化学方程式;
②依据蒸馏实验过程和实验装置分析需要的玻璃仪器;
(2)依据所给的热化学方程式结合要求的反应,利用盖斯定律来解题.
解答 解:(1)①工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应的化学方程式为:N2+3H2 $\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$2NH3,NO一定条件下可与氨气反应转化为氮气,结合原子守恒配平书写得到化学方程式为:6NO+4NH3$\frac{\underline{\;一定条件\;}}{\;}$5N2+6H2O,
故答案为:N2+3H2 $\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$2NH3,6NO+4NH3$\frac{\underline{\;一定调价\;}}{\;}$5N2+6H2O;
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有:蒸馏烧瓶、温度计、冷凝管;
故答案为:蒸馏烧瓶、温度计、冷凝管;
(2)CO(g)+$\frac{1}{2}$O2 (g)═CO2 (g)△H=-282kJ•mo-1 ①
H2 (g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mo-1 ②
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-846.3kJ•mo-1 ③.
将③-①-②×3可得:CH4 (g)+H2O(g)═CO(g)+3H2 (g)△H=(-846.3kJ•mo-1)-(-282kJ•mo-1)-(-241.8kJ•mo-1)×3=-322.5 kJ•mo-1,
故答案为:CH4 (g)+H2O(g)═CO(g)+3H2 (g)△H=-322.5 kJ•mo-1.
点评 本题考查了燃烧热概念和热化学方程式的书写计算应用,掌握概念实质和热化学方程式书写方法是解题关键.题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案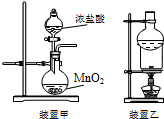
| A. | 用装置甲可以制备氯气 | |
| B. | 用装置乙分离泥沙中的碘单质 | |
| C. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| D. | 用玻璃棒蘸取NaClO溶液点在pH试纸上,测定溶液的pH |
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| B | 氯气中混有氯化氢气体 | 洗气 | 氯气和氯化氢在饱和食盐水中溶解度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离CCl4和碘的混合溶液 | 升华 | CCl4和碘沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 3.0×1023 | B. | 3.0×1024 | C. | 7.5×1022 | D. | 7.5×1023 |
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: .
. 、
、 .
.