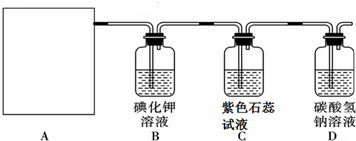
题目内容
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,40 g SO3所含的氧原子的数目为1.5 NA | |
| B. | 5.6 g铁与足量氯气或硫蒸气反应转移的电子数均为0.3 NA | |
| C. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| D. | 常温下5.6 g铁投入到足量浓硝酸中反应,转移电子数为0.3 NA |
分析 A、求出三氧化硫的物质的量,然后根据1mol三氧化硫中含3mol氧原子来分析;
B、铁与氯气反应变为+3价,而与硫蒸汽反应变为+2价;
C、12.5mL 16mol/L浓硫酸溶质物质的量=0.0125L×16mol/L=0.2mol,全部反应生成二氧化硫0.1mol,随反应进行浓度减小,稀硫酸不和铜反应;
D、常温下,铁在浓硝酸中会钝化.
解答 解:A、40g三氧化硫的物质的量n=$\frac{40g}{80g/mol}$=0.5mol,而1mol三氧化硫含3mol氧原子,故0.5mol三氧化硫含1.5mol氧原子,即1.5NA个,故A正确;
B、5.6g铁的物质的量n=$\frac{5.6g}{56g/mol}$=0.1mol,铁与氯气反应变为+3价,故0.1mol铁失去0.3mol电子;而与硫蒸汽反应变为+2价,故0.1mol铁失去0.2mol电子,故B错误;
C、12.5mL 16mol/L浓硫酸溶质物质的量=0.0125L×16mol/L=0.2mol,全部反应生成二氧化硫0.1mol,随反应进行浓度减小,稀硫酸不和铜反应,转移的电子数小于0.1NA,故C错误;
D、常温下,铁在浓硝酸中会钝化,反应程度很小,铁不能反应完全,故转移的电子数小于0.3NA,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,应熟练掌握公式的运用和反应进行的情况,难度不大.

练习册系列答案
相关题目
20.下列气态氢化物中最稳定的是( )
| A. | PH3 | B. | NH3 | C. | H2O | D. | CH4 |
2.化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是( )
| A. | 光化学烟雾是氮氧化物受紫外线照射后与空气中的一些碳氢化合物作用后生成的一种有毒烟雾 | |
| B. | 以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇 | |
| C. | 航天飞机上使用的隔热陶瓷瓦,大多是以碳纤维做增强体的新型复合材料 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
19.如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为 ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl;
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl;
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
6.下列实验完毕后,一定能出现白色浑浊现象的是( )
| A. | 浓苯酚溶液中滴加少量稀溴水 | B. | NaAlO2溶液滴入过量苯酚溶液 | ||
| C. | 稀苯酚钠溶液中通入少量CO2 | D. | AgNO3溶液中滴入过量氨水 |
3.下列各组粒子,核外电子总数和质子总数均相同的是( )
| A. | S2-和HS- | B. | H3O+和OH- | C. | Na+和NH${\;}_{4}^{+}$ | D. | K+和Ne |
20.奥运会中,禁止运动员使用兴奋剂是奥运会的重要举措之一.以下两种兴奋剂的结构分别为:
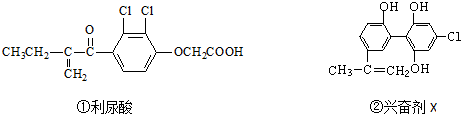
则关于它们的说法中正确的是( )
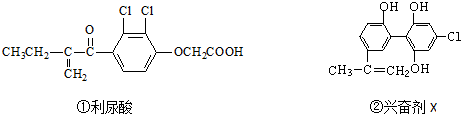
则关于它们的说法中正确的是( )
| A. | 利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰 | |
| B. | 1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 | |
| C. | 两种兴奋剂最多都能和含3molNaOH的溶液反应 | |
| D. | 两种分子中的所有碳原子均不可能共平面 |