题目内容
【题目】根据要求填写下列空白。
(1)实验室制取CO2的离子反应方程式:________________________________________;
(2)氢氧化钡和硫酸镁溶液混合反应的离子方程式:_______________________________;
(3)氢氧化铁胶体制备的离子反应:_____________________________________________;
(4)同温同压条件下,等质量的CO和CO2的密度比为:__________。
(5)在NaH+H2O=NaOH+H2↑中,还原剂为________,生成1molH2时转移电子为___mol。
【答案】CaCO3 +2H+ = Ca2++CO2↑+H2O Ba2+ + 2OH+Mg2++ SO42= BaSO4↓+Mg(OH)2↓ Fe3+ + 3H2O ![]() Fe(OH)3(胶体)+ 3H+ 7:11 NaH 1
Fe(OH)3(胶体)+ 3H+ 7:11 NaH 1
【解析】
(1)实验室利用CaCO3和HCl制取CO2的离子方程式:CaCO3+2H+= Ca2++CO2↑+H2O,
故答案为:CaCO3 +2H+ = Ca2++CO2↑+H2O;
(2)氢氧化钡和硫酸镁溶液混合反应生成BaSO4和Mg(OH)2沉淀,离子方程式:Ba2+ + 2OH+Mg2++ SO42= BaSO4↓+Mg(OH)2↓,
故答案为:Ba2+ + 2OH+Mg2++ SO42= BaSO4↓+Mg(OH)2↓;
(3)氢氧化铁胶体制备的离子反应:Fe3+ + 3H2O ![]() Fe(OH)3(胶体)+ 3H+,
Fe(OH)3(胶体)+ 3H+,
故答案为:Fe3+ + 3H2O ![]() Fe(OH)3(胶体)+ 3H+;
Fe(OH)3(胶体)+ 3H+;
(4)同温同压下,气体的密度比等于其摩尔质量之比,CO和CO2的密度比为:28g/mol:44g/mol=7:11,
故答案为:7:11;
(5)方程式NaH+H2O=NaOH+H2↑中NaH中的氢为-1价,H2O的氢为+1价,反应后都生成0价的氢气,所以还原剂为NaH,每生成1molH2转移1mol电子,
故答案为:NaH ;1。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
(一)利用下列装置制备NaNO2。
已知:①2NO+Na2O2=2NaNO2;② NO和NO2-均能被酸性高锰酸钾氧化为NO3-。
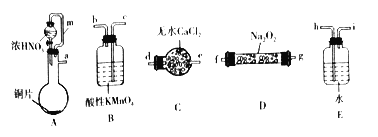
(1)选择上述仪器完成实验,其连按顺序为_______________(按气流方向,用小写字母表示)。
(2)装置A中m管的作用为_________________。
(3)装置B中发生反应的离子方程式为____________________________________________________。
(二)测定上述实验所制备的NaNO2样品(含NaNO3和Na2CO3 杂质)的纯度。
称量D中所得样品ag溶解后配制成250 mL 溶液,取25.00mL于锥形瓶用6mol·L-1 的酸性高锰酸钾溶液滴定到终点;重复上述滴定操作两次,测得数据如下表:
第一次 | 第二次 | 第三次 | |
酸性高锰酸钾溶液休积/mL | 19.98 | 19.75 | 20.02 |
(4)盛装酸性高锰酸钾溶液前需对酸式滴定管进行的操作为__________________________。
(5)滴定到终点的实验现象为_________________________________________________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2 的质量分数为_____________(用含a、b的关系式表示)。


