题目内容
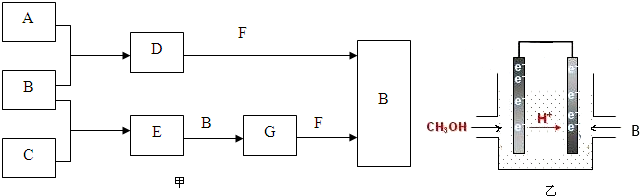
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,G是一种常见的温室气体.其转化关系如图甲(反应条件和部分产物略去).试回答:
(1)G的电子式是 .
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 .
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等.Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 .
(4)G的大量排放会引发很多环境问题.有科学家提出,用G和H2合成CH3OH和H2O,对G进行综合利用.25℃,101kPa时,该反应的热化学方程式是:
(已知甲醇的燃烧热△H=-726.5kJ?mol-1,氢气的燃烧热△H=-285.8kJ?mol-1);
又知CH3OH与单质B可组成如图乙的燃料电池,试写出负极的电极反应式: .
(5)在一个绝热的恒容密闭容器中,发生如下反应:E(g)+D(g)?A(g)+G(g)
①判断此反应达平衡的标志是
A、体系的压强不再发生变化;
B、混合气体的密度不变;
C、混合气体的平均相对分子质量不变;
D、各组分的物质的量浓度不再改变;
E、体系的温度不再发生变化.
②830k时若起始时C(E)=2mol/L,C( D)=3mol/L.平衡时E的转化率为60%,则830k 时平衡常数K值为 .

(1)G的电子式是
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等.Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
(4)G的大量排放会引发很多环境问题.有科学家提出,用G和H2合成CH3OH和H2O,对G进行综合利用.25℃,101kPa时,该反应的热化学方程式是:
(已知甲醇的燃烧热△H=-726.5kJ?mol-1,氢气的燃烧热△H=-285.8kJ?mol-1);
又知CH3OH与单质B可组成如图乙的燃料电池,试写出负极的电极反应式:
(5)在一个绝热的恒容密闭容器中,发生如下反应:E(g)+D(g)?A(g)+G(g)
①判断此反应达平衡的标志是
A、体系的压强不再发生变化;
B、混合气体的密度不变;
C、混合气体的平均相对分子质量不变;
D、各组分的物质的量浓度不再改变;
E、体系的温度不再发生变化.
②830k时若起始时C(E)=2mol/L,C( D)=3mol/L.平衡时E的转化率为60%,则830k 时平衡常数K值为
考点:无机物的推断
专题:推断题
分析:A、B、C是三种常见短周期元素的单质,A与B反应生成D,常温下D为无色液体,D应为H2O,G是一种常见的温室气体,应为CO2,则A为H2,B为O2,C为碳,水、二氧化碳都与F反应生成氧气,则F为Na2O2,而碳与氧气反应生成E,E与氧气反应生成二氧化碳,故E为CO,据此解答.
(1)CO2分子中碳原子与氧原子之间形成2对共用电子对;
(2)单质X和B或D均能反应生成黑色磁性固体Y,则X为Fe,Y为四氧化三铁;
(3)Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18,则Z应为O3,与KI反应生成O2和I2;
(4)根据甲醇、氢气的燃烧热,书写其燃烧的热化学方程式,再根据盖斯定律写出二氧化碳与氢气合成甲醇与水的热化学方程式,标注物质聚集状态和对应反应的焓变;
CH3OH与氧气可组成如图乙的燃料电池,负极发生氧化反应,甲醇在负极失去电子,酸性条件下生成二氧化碳与氢原子;
(5)①反应到达平衡时,各组分的浓度、含量不变,由此衍生的其它一些物理量不再变化,应选择变化的物理量,当该物理量由变化到不变化,说明到达平衡,不能选择始终不变的物理量;
②根据三段式计算平衡时各组成的浓度,代入平衡常数k=
计算.
(1)CO2分子中碳原子与氧原子之间形成2对共用电子对;
(2)单质X和B或D均能反应生成黑色磁性固体Y,则X为Fe,Y为四氧化三铁;
(3)Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18,则Z应为O3,与KI反应生成O2和I2;
(4)根据甲醇、氢气的燃烧热,书写其燃烧的热化学方程式,再根据盖斯定律写出二氧化碳与氢气合成甲醇与水的热化学方程式,标注物质聚集状态和对应反应的焓变;
CH3OH与氧气可组成如图乙的燃料电池,负极发生氧化反应,甲醇在负极失去电子,酸性条件下生成二氧化碳与氢原子;
(5)①反应到达平衡时,各组分的浓度、含量不变,由此衍生的其它一些物理量不再变化,应选择变化的物理量,当该物理量由变化到不变化,说明到达平衡,不能选择始终不变的物理量;
②根据三段式计算平衡时各组成的浓度,代入平衡常数k=
| c(H2)×c(CO2) |
| c(CO)×c(H2O) |
解答:
解:A、B、C是三种常见短周期元素的单质,A与B反应生成D,常温下D为无色液体,D应为H2O,G是一种常见的温室气体,应为CO2,则A为H2,B为O2,C为碳,水、二氧化碳都与F反应生成氧气,则F为Na2O2,而碳与氧气反应生成E,E与氧气反应生成二氧化碳,故E为CO,
(1)G为CO2,电子式是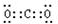 ,故答案为:
,故答案为: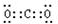 ;
;
(2)单质X和氧气或水均能反应生成黑色晶体Y,则X为Fe,Y为Fe3O4,Fe与水生成四氧化三铁的化学方程式是:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:Fe3O4;
(3)Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18,则Z应为O3,与KI反应生成O2和I2,反应的离子方程式为O3+2H++2I-=O2+I2+H2O,故答案为:O3+2H++2I-=O2+I2+H2O;
(4)甲醇的燃烧热△H=-726.5kJ?mol-1,可得甲醇燃烧的热化学方程式:①CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ?mol-1,
氢气的燃烧热△H=-285.8kJ?mol-1,可得氢气燃烧的热化学方程式:②H2(g)+
O2(g)═H2O(l)△H=-285.8 kJ?mol-1,
根据盖斯定律,②×3-①得:CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol,
CH3OH与氧气可组成如图乙的燃料电池,负极发生氧化反应,甲醇在负极失去电子,酸性条件下生成二氧化碳与氢原子,负极电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol;CH3OH-6e-+H2O=CO2+6H+;
(5)在一个绝热的恒容密闭容器中,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),
①A、反应气体气体体积不变,反应过程之后压强始终不变,体系的压强不再发生变化不能判断反应到达平衡,故A错误;
B、混合气体总质量不变,体积不变,则混合气体的密度始终不变,不能判断反应到达平衡,故B错误;
C、混合气体总质量不变,总物质的量不变,混合气体的平均相对分子质量始终不变,不能判断反应到达平衡,故C错误;
D、各组分的物质的量浓度不再改变,说明反应到达平衡,故D正确;
E、反应具有热效应,体系的温度不再发生变化,说明反应到达平衡,故E正确,
故答案为:DE;
②830k时若起始时C(CO)=2mol/L,C( H2O)=3mol/L.平衡时E的转化率为60%,E的浓度变化量为1.2mol.L,
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
则830k 时平衡常数K=
=1,
故答案为:1.
(1)G为CO2,电子式是
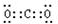 ,故答案为:
,故答案为: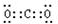 ;
;(2)单质X和氧气或水均能反应生成黑色晶体Y,则X为Fe,Y为Fe3O4,Fe与水生成四氧化三铁的化学方程式是:3Fe+4H2O(g)
| ||
(3)Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18,则Z应为O3,与KI反应生成O2和I2,反应的离子方程式为O3+2H++2I-=O2+I2+H2O,故答案为:O3+2H++2I-=O2+I2+H2O;
(4)甲醇的燃烧热△H=-726.5kJ?mol-1,可得甲醇燃烧的热化学方程式:①CH3OH(l)+
| 3 |
| 2 |
氢气的燃烧热△H=-285.8kJ?mol-1,可得氢气燃烧的热化学方程式:②H2(g)+
| 1 |
| 2 |
根据盖斯定律,②×3-①得:CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol,
CH3OH与氧气可组成如图乙的燃料电池,负极发生氧化反应,甲醇在负极失去电子,酸性条件下生成二氧化碳与氢原子,负极电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol;CH3OH-6e-+H2O=CO2+6H+;
(5)在一个绝热的恒容密闭容器中,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),
①A、反应气体气体体积不变,反应过程之后压强始终不变,体系的压强不再发生变化不能判断反应到达平衡,故A错误;
B、混合气体总质量不变,体积不变,则混合气体的密度始终不变,不能判断反应到达平衡,故B错误;
C、混合气体总质量不变,总物质的量不变,混合气体的平均相对分子质量始终不变,不能判断反应到达平衡,故C错误;
D、各组分的物质的量浓度不再改变,说明反应到达平衡,故D正确;
E、反应具有热效应,体系的温度不再发生变化,说明反应到达平衡,故E正确,
故答案为:DE;
②830k时若起始时C(CO)=2mol/L,C( H2O)=3mol/L.平衡时E的转化率为60%,E的浓度变化量为1.2mol.L,
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
则830k 时平衡常数K=
| 1.2×1.2 |
| 0.8×1.8 |
故答案为:1.
点评:本题以考查无机物推断为载体,考查电子式、热化学方程式、原电池电极反应式、平衡状态的判断、平衡常数计算,题目综合较大,需要学生晶胞扎实的基础,注意平衡状态的判断应选择变化的物理量,当该物理量由变化到不变化,说明到达平衡,不能选择始终不变的物理量,难度中等.

练习册系列答案
相关题目
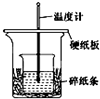 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )| A、如图条件下实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是固定小烧杯 |
| D、若改用60 mL 0.50 mol/L盐酸跟60 mL 0.50 mol/L的NaOH溶液进行反应,所放出热量相等 |
下列实验设计方案中,可行的是( )
| A、用加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3 |
| B、某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- |
| C、向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- |
| D、先后滴加紫色石蕊试液、BaCl2溶液,可以将盐酸、硫酸氢钠、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
某课外实验小组设计的下列实验合理的是( )
A、 制备少量氧气 |
B、 配制一定浓度硫酸溶液 |
C、 制备并收集少量NO2气体 |
D、 制备少量氨气 |
下列气体中,既能用浓硫酸干燥,又能用碱石灰干燥的( )
| A、C12 |
| B、NH3 |
| C、C02 |
| D、02 |
生活中经常用到物质分离提纯的方法,以下说法错误的是( )
| A、海水淡化是利用蒸馏的原理 |
| B、用过滤的原理使用纱布将豆腐花和豆浆分离 |
| C、酿酒时用萃取的原理将酒精的纯度提高 |
| D、海水晒盐使用了蒸发的原理 |
下列溶液中不能存放在带玻璃塞的试剂瓶中的是( )
①氢氟酸 ②NaCl ③KNO3 ④石灰水 ⑤CuSO4 ⑥NaOH ⑦Na2CO3 ⑧NaHSO4.
①氢氟酸 ②NaCl ③KNO3 ④石灰水 ⑤CuSO4 ⑥NaOH ⑦Na2CO3 ⑧NaHSO4.
| A、①④⑥⑦ | B、①③⑤⑧ |
| C、②③④⑦ | D、①④⑥⑧ |
下列做法与可持续发展理念不符合的是( )
| A、加大清洁能源的开发利用,提高资源的利用率 |
| B、推广碳捕集和储存技术,逐步实现二氧化碳零排放 |
| C、加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求 |
| D、对工业废水、生活污水净化处理,减少污染物的排放 |
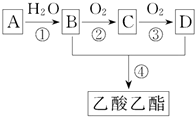 一股淡淡清香能给人心旷神怡的感觉,主要由香精、酒精和水构成的香水备受爱美人士的青睐.香精里面含有酯类物质,工业上以A为主要原料来合成乙酸乙酯,其合成路线如图所示.其中A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.又知
一股淡淡清香能给人心旷神怡的感觉,主要由香精、酒精和水构成的香水备受爱美人士的青睐.香精里面含有酯类物质,工业上以A为主要原料来合成乙酸乙酯,其合成路线如图所示.其中A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.又知