题目内容
【题目】焦亚硫酸钠(Na2S2O5)在食品加工中常作防腐剂、漂白剂、疏松剂,焦亚硫酸钠具有还原性,受潮和温度高于150℃易分解。焦亚硫酸钠与亚硫酸氢钠的转化关系是:Na2S2O5![]() NaHSO3。工业上制取原理是用纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至过饱和,再从亚硫酸氢钠过饱和溶液中结晶析出焦亚硫酸钠产品。实验室模拟制取焦亚硫酸钠流程如图。
NaHSO3。工业上制取原理是用纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至过饱和,再从亚硫酸氢钠过饱和溶液中结晶析出焦亚硫酸钠产品。实验室模拟制取焦亚硫酸钠流程如图。

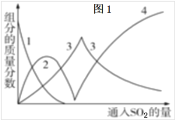
(1)Ⅰ中用Na2CO3溶液吸收SO2,随着SO2的持续通入,溶液中各组分的质量分数变化如图1所示。图中线2表示的组分是___(填化学式,下同)。Ⅰ中产物是___。
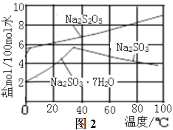
(2)实验时采用80℃的水浴加热,反应后的体系中有少量亚硫酸钠析出,根据图2溶解度曲线,获得较纯的无水Na2S2O5的方法是___。

(3)图3为真空干燥Na2S2O5晶体的装置,真空干燥的目的是___。
(4)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O![]() +2I2+3H2O=2SO
+2I2+3H2O=2SO![]() +4I-+6H+;2S2O
+4I-+6H+;2S2O![]() +I2=S4O
+I2=S4O![]() +2I-。
+2I-。
实验步骤如下:
①称取0.2000g产品放入碘量瓶中。
②加入40.00mL0.1000mol·L-1的标准碘溶液,在暗处放置5min,再加入适量冰醋酸及蒸馏水。
③用0.2000mol·L-1的标准Na2S2O3溶液滴定剩余的碘至接近终点。
④加入1~2mL淀粉溶液。
⑤继续用标准Na2S2O3溶液滴定至___,记录滴定所消耗的体积。
⑥重复步骤①~⑤;平均消耗标准Na2S2O3溶液20.00mL。则产品中焦亚硫酸钠的质量分数为___。
【答案】NaHCO3 NaHSO3 (趁热过滤)从80℃降温至35℃左右结晶、抽滤(洗涤、干燥) 真空有利于脱水、能防止晶体被氧化,避免烘干温度过高分解 当溶液由蓝色变为无色,且维持半分钟稳定 95.00%
【解析】
本实验通过利用碳酸钠溶液与二氧化硫的反应制备焦亚硫酸钠;向碳酸钠溶液中通入二氧化硫,经过反应在pH为4.1时基本完成制备亚硫酸氢钠;加入碳酸钠固体调节pH至7~8,纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至饱和,即形成亚硫酸钠悬浮液;继续通入二氧化硫调节pH至4.1,生成亚硫酸氢钠的过饱和溶液,再从亚硫酸氢钠的过饱和溶液中结晶析出焦亚硫酸钠产品,因为焦亚硫酸钠既有还原性,受潮和温度高于150℃易分解的性质,得到产品的实验步骤是低温结晶,快速过滤,真空干燥;据此分析。
(1) 碳酸钠溶液中通入二氧化硫,碳酸钠减少,生成碳酸氢钠,浓度逐渐增大,线2为碳酸氢钠,线1为碳酸钠;继续通入二氧化硫,碳酸氢钠减少亚硫酸钠增加,线3为亚硫酸钠,在继续通入二氧化硫亚硫酸氢钠增加,线4为亚硫酸氢钠,则线2为碳酸氢钠;Ⅰ中产物溶液呈酸性,故为亚硫酸氢钠;
(2)由于焦亚硫酸钠的溶解度随温度降低而减小,此时应趁热过滤,以免温度降低而导致焦亚硫酸钠晶体析出,随后应将溶液温度降低至35℃左右,此时溶液中可以析出大量的焦亚硫酸钠同时也防止Na2SO3·7H2O由于温度过低而析出;
(3)真空干燥有利于快速脱水,且能防止晶体被氧化,避免烘干温度过高分解;
(4)⑤用硫代硫酸钠滴定至终点时,溶液中的I2全部反应,故滴定终点的现象为:当溶液由蓝色变为无色,且维持半分钟内颜色稳定不变色
⑥根据题目所给方程式,硫代硫酸根和I2的物质的量关系为2![]() ~I2,则n(I2)=
~I2,则n(I2)=![]() n(
n(![]() )=
)=![]() ×0.2000mol/L×20.00×10-3L=2×10-3mol,则与焦亚硫酸根反应的I2的物质的量为40.00×10-3L×0.1000mol/L-2×10-3mol=2×10-3mol,根据焦亚硫酸根与碘反应的方程式可知,
×0.2000mol/L×20.00×10-3L=2×10-3mol,则与焦亚硫酸根反应的I2的物质的量为40.00×10-3L×0.1000mol/L-2×10-3mol=2×10-3mol,根据焦亚硫酸根与碘反应的方程式可知,![]() ~2I2,则n(
~2I2,则n(![]() )=
)=![]() n(I2)=
n(I2)=![]() ×2×10-3mol=1×10-3mol,则n(Na2S2O5)= 4×10-3mol,m(Na2S2O5)=1×10-3mol×190g/mol=0.19g,则产品中焦亚硫酸钠的质量分数为
×2×10-3mol=1×10-3mol,则n(Na2S2O5)= 4×10-3mol,m(Na2S2O5)=1×10-3mol×190g/mol=0.19g,则产品中焦亚硫酸钠的质量分数为![]() =95%。
=95%。

 字词句段篇系列答案
字词句段篇系列答案