题目内容
已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大.X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素.
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) .
(2)Z在元素周期表中的位置为 .
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) .
(4)常温下,不能与G的单质发生反应的是(填序号) .
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)已知图1化合物C含有上述元素中的某一种元素
①若D是一种强酸,则C与水反应的化学方程式为 .
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如图2装置进行实验.分液漏斗中应加入 ,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是 .
②若D是一种常见的强碱,则C与水反应的离子方程式为 .

请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)
(2)Z在元素周期表中的位置为
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)
(4)常温下,不能与G的单质发生反应的是(填序号)
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)已知图1化合物C含有上述元素中的某一种元素
①若D是一种强酸,则C与水反应的化学方程式为
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如图2装置进行实验.分液漏斗中应加入
②若D是一种常见的强碱,则C与水反应的离子方程式为

考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大,G是地壳中含量最高的金属元素,故G是铝;
Z的气态氢化物能与其最高价氧化物的水化物反应,故Z是氮;
Y的原子最外层电子数是其电子层数的2倍,Y的原子序数小于N,故Y是碳;
X单质在常温下呈气态,且原子序数小于C,故X是氢;
X与M同主族,M的原子序数小于铝,大于氧,故M是钠;
Q常温下为气体,故Q是氯,据此回答下列问题即可.
Z的气态氢化物能与其最高价氧化物的水化物反应,故Z是氮;
Y的原子最外层电子数是其电子层数的2倍,Y的原子序数小于N,故Y是碳;
X单质在常温下呈气态,且原子序数小于C,故X是氢;
X与M同主族,M的原子序数小于铝,大于氧,故M是钠;
Q常温下为气体,故Q是氯,据此回答下列问题即可.
解答:
解:依据分析可知:X为氢,Y为碳,Z为氮,M为钠,G为铝,Q为氯,
(1)C、N、Na、Cl四种元素,周期数越大原子半径越大,同一周期,原子序数越小,半径越大,故四种原子由大到小的顺序是:Na>Al>C>N,故答案为:Na>Al>C>N;
(2)Z为氮,N在元素周期表中的位置为第二周期第ⅤA族,故答案为:第二周期第ⅤA族;
(3)元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,由于Cl元素的非金属性越强,故上述元素的最高价氧化物对应的水化物酸性最强的是:高氯酸,即HClO4,故答案为:HClO4;
(4)由于Al的活泼性强与Cu,故Al能与CuSO4溶液反应置换出Cu,故a不选;
Al的还原性较强,能在高温下与Fe2O3反应,但在常温下不反应,故b选;
Al与浓硫酸在冷的条件下钝化,故c不选;
Al具有两性,能与NaOH溶液反应生成偏铝酸钠和氢气,故d不选;
Al与Na2CO3固体不能反应,故选e,故答案为:be;
(5)①若D是一种强酸,则此强酸为硝酸,即NO2与水反应生成HNO3和NO,化学反应方程式为:3NO2+H2O=2HNO3+NO;浓硝酸与Cu反应生成二氧化氮,故分液漏斗中加入的应是浓硝酸,由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,故答案为:3NO2+H2O=2HNO3+NO;浓硝酸;NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2;
②若D是一种常见的强碱,则D为氢氧化钠,即过氧化钠与水反应生成氢氧化钠与氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
(1)C、N、Na、Cl四种元素,周期数越大原子半径越大,同一周期,原子序数越小,半径越大,故四种原子由大到小的顺序是:Na>Al>C>N,故答案为:Na>Al>C>N;
(2)Z为氮,N在元素周期表中的位置为第二周期第ⅤA族,故答案为:第二周期第ⅤA族;
(3)元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,由于Cl元素的非金属性越强,故上述元素的最高价氧化物对应的水化物酸性最强的是:高氯酸,即HClO4,故答案为:HClO4;
(4)由于Al的活泼性强与Cu,故Al能与CuSO4溶液反应置换出Cu,故a不选;
Al的还原性较强,能在高温下与Fe2O3反应,但在常温下不反应,故b选;
Al与浓硫酸在冷的条件下钝化,故c不选;
Al具有两性,能与NaOH溶液反应生成偏铝酸钠和氢气,故d不选;
Al与Na2CO3固体不能反应,故选e,故答案为:be;
(5)①若D是一种强酸,则此强酸为硝酸,即NO2与水反应生成HNO3和NO,化学反应方程式为:3NO2+H2O=2HNO3+NO;浓硝酸与Cu反应生成二氧化氮,故分液漏斗中加入的应是浓硝酸,由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,故答案为:3NO2+H2O=2HNO3+NO;浓硝酸;NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2;
②若D是一种常见的强碱,则D为氢氧化钠,即过氧化钠与水反应生成氢氧化钠与氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
点评:本题主要考查的是元素的推断以及元素周期律的应用,包含原子半径大小比较、离子反应方程式书写等,属于中等难度的题目.

练习册系列答案
相关题目
下列有关物质性质实验的叙述,正确的是( )
| A、钠在空气中燃烧,生成淡黄色的氧化钠粉末 |
| B、钠是一种强还原剂,可以把钛从其盐溶液中置换出 |
| C、将灼热的铁丝放入盛有氯气的集气瓶中,生成棕黄色的氯化铁烟雾 |
| D、Fe(OH)3胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,因而常用于净水 |
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A、水合氢离子电子式: | ||
| B、二氧化硅的分子式:SiO2 | ||
C、中子数为79、质子数为55 的铯(Cs)原子
| ||
D、离子结构示意图 :可以表示16O2-,也可以表示18O2- :可以表示16O2-,也可以表示18O2- |
下列说法正确的是( )
| A、福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| B、分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定高 |
| C、CO2、H2O、N2这些分子中所有原子都满足最外层为8电子的结构 |
D、原子结构模型的演变经历了: |
以CH3COOH?CH3COO-+H+的电离平衡为例:回答下列问题:
| 改变条件 | 平衡移动方向 | C(H+)C(OH-)C(CH3COO-)电离程度的变化 |
| 加入镁粉 | ||
| 升高温度 | ||
| 通入NaOH(s) | ||
| 通入HCl(g) |
要将NaCl、Na2SO4、NaHCO3、Na2CO3四瓶无标签的稀溶液区别开来,最适宜的试剂组是( )
| A、稀硝酸、BaCl2溶液 |
| B、稀硫酸、Ba(OH)2溶液 |
| C、稀盐酸、AgNO3溶液 |
| D、NaOH和CaCl2溶液 |
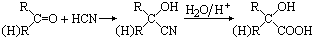 ,
,