题目内容
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。
①电解池中X极上的电极反应式为____________,在X极附近观察到的实验现象是_________
_____________________________________________________________________;
②Y电极上的电极反应式为____________,检验该电极反应产物的方法是________________
_____________________________________________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是__________,电极反应式为__________。
②Y电极的材料是__________,电极反应式为__________。
(说明:杂质发生的电极反应不必写出)
解析:电解饱和NaCl溶液时,H+移向阴极得电子生成氢气,2H++2e-![]() H2↑,促进了水的电离,阴极附近呈碱性,酚酞变红。Y极上Cl-失电子,2Cl--2e-
H2↑,促进了水的电离,阴极附近呈碱性,酚酞变红。Y极上Cl-失电子,2Cl--2e-![]() Cl2↑,用KI淀粉试纸检验。
Cl2↑,用KI淀粉试纸检验。
粗铜精炼时,粗铜作阴极,粗铜是活性电极失电子,Cu-2e-![]() Cu2+,纯铜作阳极,Cu2++2e-
Cu2+,纯铜作阳极,Cu2++2e-![]() Cu。
Cu。
答案:(1)①2H++2e-![]() H2↑ 阴极附近变红色
H2↑ 阴极附近变红色
②2Cl--2e-![]() Cl2↑ 把湿润的KI淀粉试纸放在Y电极附近,试纸变蓝色
Cl2↑ 把湿润的KI淀粉试纸放在Y电极附近,试纸变蓝色
(2)①粗铜 Cu-2e-![]() Cu2+
Cu2+
②纯铜 Cu2++2e-![]() Cu
Cu

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: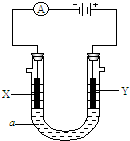 (I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
(I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2. 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.