题目内容
【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法不正确的是___
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2__T1(填“>,<或=”)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是__(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=__。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向___反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__mol。
2NH3(g) △H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__mol。
(6)已知:![]() 2NH3(g) △H=-92kJ/mol
2NH3(g) △H=-92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式__。
【答案】ABC c 减少生成物浓度,同时增加反应物浓度,可以使平衡正向进行程度更大,提高产率 < c 0.1 逆 3 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906kJ·mol-1
【解析】
(1)当△G=△H-T△S<0反应能自发进行,由于该反应△H<0,△S<0,因此当低温下该反应能够自发进行,只根据△H<0或△S<0,不能判断该反应能否自发进行;工业上合成氨的反应条件是在高温、高压、催化剂条件下进行反应的,在高温下进行是为了使催化剂达到最大活性,加快反应速率, 使用催化剂低了反应的活化能,因此加快反应速率;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)根据浓度对化学平衡的影响以及对原料利用率的影响来分析;及时分离出氨气,生成物的浓度减少,平衡正向移动,提高氨气的产率;循环利用氮气和氢气,提高氮气和氢气的转化率;
(4)①根据温度对化学平衡移动的影响知识来回答;
②根据a、b、c三点所表示的意义来回答;
(5)①由表中数据可知,20min达平衡,平衡时NH3的浓度为0.20mol/L,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式k=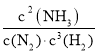 计算;
计算;
②温度不变平衡常数不变,计算此时的浓度,进而计算浓度商Qc,比较浓度商与平衡常数的大小,判断反应进行方向;
③恒温恒容条件下,气体的压强之比等于其物质的量之比,反应达到平衡后,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则反应前混合气体的物质的量为4mol,反应前混合气体的物质的量为4mol,为氢气和氮气的物质的量之和;
(1)A. 当△G=△H-T△S<0反应能自发进行,由于该反应△H<0,△S<0,因此当低温下该反应能够自发进行,只根据△H<0,不能判断该反应能否自发进行,故A错误;
B. 当△G=△H-T△S<0反应能自发进行,由于该反应△H<0,△S<0,因此当低温下该反应能够自发进行,只根据△S<0,不能判断该反应能否自发进行,故B错误;
C.工业上合成氨的反应条件是在高温、高压、催化剂条件下进行反应的,在高温下进行是为了使催化剂达到最大活性,加快反应速率,故C错误;
D.使用催化剂低了反应的活化能,因此加快反应速率,故D正确;
答案选ABC;
(2)a. 容器内N2、H2、NH3的浓度之比为1:3:2,不能说明浓度不变,故a错误;
b. v(N2)正=3v(H2)正是同向的反应速率,不能说明反应达平衡状态,故b错误;
c. 容器内压强保持不变,说明气体的物质的量不变,反应达平衡状态,故c正确;
d. 混合气体的密度一直保持不变,故d错误;
答案选c;
(3)生成物的浓度减少,平衡正向移动,所以及时分离出氨气,平衡正向移动,提高氨气的产率;循环利用氮气和氢气,提高氮气和氢气的转化率,
答案为:减少生成物浓度,同时增加反应物浓度,可以使平衡正向进行程度更大,提高产率;
(4)①反应为放热反应,温度升高化学平衡向着吸热方向进行,升高温度氨气的含量降低,则T1>T2,
故答案为<;
②b点代表平衡状态,c、d点又加入了氢气,故平衡向右移动,氮气的转化率增大,T1>T2,温度升高化学平衡向着吸热方向进行,升高温度氨气的含量降低,因此c点的氮气转化率大于d点,
故答案为c;
(5)①由表中数据可知,20min达平衡,平衡时NH3的浓度为0.20mol/L,则:
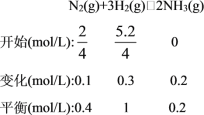
故平衡常数K=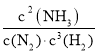 =
=![]() =0.1
=0.1
答案为:0.1;
②反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各4mol,则此时各物质的浓度为:
H2为1mol/L+![]() =2mol/L,N2为0.4mol/L+
=2mol/L,N2为0.4mol/L+![]() =1.4mol/L,NH3为0.2mol/L+
=1.4mol/L,NH3为0.2mol/L+![]() =1.2mol/L,故浓度商Qc=
=1.2mol/L,故浓度商Qc=![]() =0.13>0.1,故反应向逆反应进行,
=0.13>0.1,故反应向逆反应进行,
答案为:逆;
③恒温恒容条件下,气体的压强之比等于其物质的量之比,反应达到平衡后,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则反应前混合气体的物质的量为4mol,即反应前氢气和氮气的物质的量为4mol,由于氮气的物质的量为1mol,则氢气的物质的量为3mol,
答案为:3;
(6)已知:①N2(g)+O2(g)=
②N2(g)+3H2(g)2NH3(g) △H=-92kJ/mol
③2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
由盖斯定律可知,①×2-②×2+③×3得: 氨气催化氧化生成NO和水蒸气的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH =-906kJ·mol-1,
答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906kJ·mol-1;