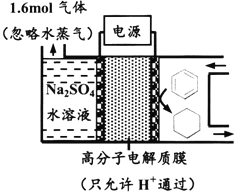
题目内容
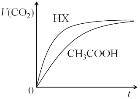
【题目】25℃时,将20mL 0.10 mol/LCH3COOH溶液和20mL 0.10 mol/LHX溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,测得产生气体的体积(V)随时间(t)变化如下图,下列说法中不正确的是
A. 反应开始前,HX溶液中c(H+)大于CH3COOH中c(H+)
B. CH3COOH溶液反应结束后,c(Na+)>c(CH3COO—)
C. 反应结束后所得两溶液中,c(CH3COO—)<c(X—)
D. 由该实验可知HX为强酸
【答案】D
【解析】
酸的酸性强弱不同,导致等浓度的酸的c(H+)不同。c(H+)越大,反应速率越大,产生二氧化碳的速率越快,由图可知酸性:HX> CH3COOH。
A. 由分析可知,酸性:HX> CH3COOH,反应开始前,等浓度HX溶液中c(H+)大于CH3COOH中c(H+),故A正确;
B. CH3COOH溶液反应结束后,溶质是CH3COONa,由于CH3COO—会水解,则溶液中c(Na+)>c(CH3COO—),故B正确;
C. 反应结束后所得两溶液中,溶质分别是CH3COONa、NaX,且物质的量相等,由越弱越水解的规律可知,水解程度:CH3COO—>X—,则c(CH3COO—)<c(X—),故C正确;
D. 由该实验可知HX酸性强于CH3COOH,但无法判断HX为强酸,故D错误;
答案选D。

练习册系列答案
相关题目