题目内容
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
(1)金属腐蚀主要分为______腐蚀和______腐蚀两种.
(2)铁被腐蚀的速率由快到慢的顺序是______(填序号).
(3)①中正极的电极反应式为______,②中负极的电极反应式为______.
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上.为防护金属被腐蚀可采取的措施有______(填序号).
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与铜条连接 ④将钢管用导线与碳棒连接.
(1)金属腐蚀主要分为______腐蚀和______腐蚀两种.
(2)铁被腐蚀的速率由快到慢的顺序是______(填序号).
(3)①中正极的电极反应式为______,②中负极的电极反应式为______.
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上.为防护金属被腐蚀可采取的措施有______(填序号).
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与铜条连接 ④将钢管用导线与碳棒连接.

(1)金属的腐蚀有:与化学物质直接反应的腐蚀和构成原电池而产生电流的腐蚀,所以分为化学腐蚀和电化学腐蚀,故答案为:化学;电化学;
(2)①中铁作原电池负极而能加快铁的腐蚀,②中铁作原电池正极而被保护,所以铁被腐蚀的速率由快到慢的顺序是①>③>②,
故答案为:①>③>②;
(3)①中碳作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,②中锌作负极,负极上金属失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,
故答案为:2H2O+O2+4e-=4OH-;Zn-2e-=Zn2+;
(4)①健身器材刷油漆能阻止金属构成原电池而被腐蚀,所以能防护金属被腐蚀,故正确;
②自行车钢圈镀铬,铬是不活泼金属,所以能防护金属被腐蚀,故正确;
③将钢管用导线与铜条连接,铁、铜和电解质溶液能构成原电池,铁作原电池负极而加快被腐蚀,所以不能防护金属被腐蚀,故错误;
④将钢管用导线与碳棒连接,铁、碳和电解质溶液能构成原电池,铁作原电池负极而加快被腐蚀,所以不能防护金属被腐蚀,故错误;
故选 ①②.
(2)①中铁作原电池负极而能加快铁的腐蚀,②中铁作原电池正极而被保护,所以铁被腐蚀的速率由快到慢的顺序是①>③>②,
故答案为:①>③>②;
(3)①中碳作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,②中锌作负极,负极上金属失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,
故答案为:2H2O+O2+4e-=4OH-;Zn-2e-=Zn2+;
(4)①健身器材刷油漆能阻止金属构成原电池而被腐蚀,所以能防护金属被腐蚀,故正确;
②自行车钢圈镀铬,铬是不活泼金属,所以能防护金属被腐蚀,故正确;
③将钢管用导线与铜条连接,铁、铜和电解质溶液能构成原电池,铁作原电池负极而加快被腐蚀,所以不能防护金属被腐蚀,故错误;
④将钢管用导线与碳棒连接,铁、碳和电解质溶液能构成原电池,铁作原电池负极而加快被腐蚀,所以不能防护金属被腐蚀,故错误;
故选 ①②.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁锈蚀的影响因素,某同学做了如下探究实验:
回答下列问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) ;在电化学腐蚀中,负极反应是 ;正极反应是 ;
(2)由该实验可知,可以影响铁锈蚀速率的因素是 ;
(3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法).
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
(1)上述实验中发生了电化学腐蚀的是(填实验序号)
(2)由该实验可知,可以影响铁锈蚀速率的因素是
(3)为防止铁的锈蚀,工业上普遍采用的方法是
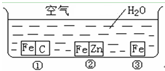 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中.请回答: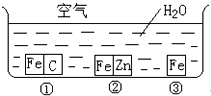 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答: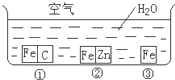 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答: