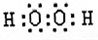题目内容
短周期中的六种元素A、B、C、X、Y、Z,原子序数依次减小,其中X、Y、Z原子核外电子层数之和是5.X元素原子最外电子层上的电子数是Y和Z两种元素最外电子层上的电子数的总和;Y元素原子的最外层电子层上的电子数是它的电子层数的2倍,X和Z可以形成化合物XZ3;C与X处于同周期,B+与C2-的核外电子排布相同,A与B处于同周期,且形成BA型化合物.请回答:
(1)Y元素的名称是 ;
(2)XZ3化合物的电子式是 ;
(3)A、B、C的离子半径由大到小的顺序为 (用元素离子符号表示);
(4)化合物XZ4A中所含有的化学键类型为 ,
该化合物水溶液可用于金属除锈,其原因是 (用离子方程式表示);
(5)元素组成的化合物XZ5YC3和足量的化合物BCZ反应的离子方程式为 .
(1)Y元素的名称是
(2)XZ3化合物的电子式是
(3)A、B、C的离子半径由大到小的顺序为
(4)化合物XZ4A中所含有的化学键类型为
该化合物水溶液可用于金属除锈,其原因是
(5)元素组成的化合物XZ5YC3和足量的化合物BCZ反应的离子方程式为
分析:六种短周期元素A、B、C、X、Y、Z原子序数依次减小,Y元素原子的最外电子层电子数是它的电子层数的2倍,结合原子序数可知,Y只能处于第二周期,故Y原子最外层电子数为4,则Y为C元素;X、Y、Z原于核外电子层数之和是5,故X、Z电子层之和为3,Z的原子序数最小,Z处于第一周期、X处于第二周期,故Z为H元素;X元素原子最外电子层上的电子数是Y和Z两种元素最外电子层上的电子数的总和,故X原子最外层电子数之和为4+1=5,则X为N元素;C与X处于同周期,B+与C2-的核外电子排布相同,则C为O元素,B原子序数大于氧元素,则B为Na元素;A与B处于同周期,且可形成BA型化合物,A为-1价,则A为Cl元素,据此解答.
解答:解:六种短周期元素A、B、C、X、Y、Z原子序数依次减小,Y元素原子的最外电子层电子数是它的电子层数的2倍,结合原子序数可知,Y只能处于第二周期,故Y原子最外层电子数为4,则Y为C元素;X、Y、Z原于核外电子层数之和是5,故X、Z电子层之和为3,Z的原子序数最小,Z处于第一周期、X处于第二周期,故Z为H元素;X元素原子最外电子层上的电子数是Y和Z两种元素最外电子层上的电子数的总和,故X原子最外层电子数之和为4+1=5,则X为N元素;C与X处于同周期,B+与C2-的核外电子排布相同,则C为O元素,B原子序数大于氧元素,则B为Na元素;A与B处于同周期,且可形成BA型化合物,A为-1价,则A为Cl元素,
(1)由上述分析可知,Y为碳元素,故答案为:碳;
(2)NH3化合物的电子式是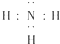 ,故答案为:
,故答案为: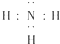 ;
;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径Cl->O2->Na+,
故答案为:Cl->O2->Na+;
(4)化合物XZ4A为NH4Cl,含有离子键和极性共价键,溶液中NH4+水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,可以用于金属除锈,
故答案为:离子键和极性共价键;NH4++H2O?NH3?H2O+H+;
(5)化合物NH5CO3为NH4HCO3,与足量NaOH反应生成NH3?H2O、碳酸钠、H2O,反应的离子方程式为:NH4++HCO3-+2OH-═NH3?H2O+CO32-+H2O,
故答案为:NH4++HCO3-+2OH-═NH3?H2O+CO32-+H2O.
(1)由上述分析可知,Y为碳元素,故答案为:碳;
(2)NH3化合物的电子式是
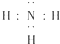 ,故答案为:
,故答案为: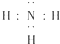 ;
;(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径Cl->O2->Na+,
故答案为:Cl->O2->Na+;
(4)化合物XZ4A为NH4Cl,含有离子键和极性共价键,溶液中NH4+水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,可以用于金属除锈,
故答案为:离子键和极性共价键;NH4++H2O?NH3?H2O+H+;
(5)化合物NH5CO3为NH4HCO3,与足量NaOH反应生成NH3?H2O、碳酸钠、H2O,反应的离子方程式为:NH4++HCO3-+2OH-═NH3?H2O+CO32-+H2O,
故答案为:NH4++HCO3-+2OH-═NH3?H2O+CO32-+H2O.
点评:本题考查结构性质位置关系运用、半径比较、盐类水解、电子式、离子方程式等,难度不大,推断元素是解题关键,注意基础知识的理解掌握.

练习册系列答案
相关题目