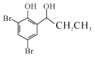
题目内容
【题目】下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-==Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
【答案】D
【解析】
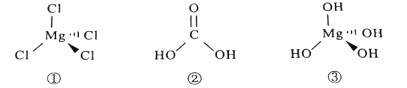
A.铁离子能够与![]() 发生络合反应;
发生络合反应;
B.根据电荷守恒判断,该离子方程式两边电荷不守恒;
C.该离子方程式不满足硫酸铁、氢氧化钡的化学组成关系;
D.根据![]() 计算出硫酸铁及铁离子的物质的量,再根据质量守恒及
计算出硫酸铁及铁离子的物质的量,再根据质量守恒及![]() 计算出铁的质量;
计算出铁的质量;
A.![]() 溶液中的
溶液中的![]() 与
与![]() 生成络合物,故在溶液中不能大量共存,故A错误;
生成络合物,故在溶液中不能大量共存,故A错误;
B.铁离子能够与碘离子发生氧化还原反应反应的离子方程式为:![]() ,题目方程式未配平,故B错误;
,题目方程式未配平,故B错误;
C.![]() 溶液和
溶液和![]() 溶液反应的生成氢氧化铁沉淀和硫酸钡沉淀,铁离子和
溶液反应的生成氢氧化铁沉淀和硫酸钡沉淀,铁离子和
硫酸根离子的物质的量的比为2:3。,正确的离子方程式为![]() ,故C错误;
,故C错误;
D.1 L 0.1 mol·L-1该溶液中含有溶质硫酸铁0.1mol,0.1mol硫酸铁中含有0.2mol铁离子,与足量锌反应可以生成0.2mol铁,生成铁的质量为11.2g,故D正确;
故选D。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目