题目内容
【题目】乳酸(![]() ) 是乳酸菌在肠道通过代谢产生,是近年来研究的热点。
) 是乳酸菌在肠道通过代谢产生,是近年来研究的热点。
(1)乳酸可发生的化学反应类型有__________。
a.取代反应 b.加成反应 c.氧化反应 d.还原反应
(2)与乳酸含有相同官能团的同分异构体的结构简式_______________。
(3)相同物质的量的乳酸分别与足量的金属钠和氢氧化钠溶液反应,消耗的金属钠与氢氧化钠的物质的量之比是__________。
(4)两个乳酸分子在一定条件下发生酯化反应既能生成六元环状化合物M,又能得到链状化合物N,则M、N的结构简式分别是________,________。
(5)可降解一次性餐盒是由乳酸在一定条件下通过___________(填反应类型)生成的高分子材料制得,合成这种高分子材料的化学方程式是________。
【答案】ac CH2OHCH2COOH 2:1  CH3CHOHCOOCH(CH3)COOH 聚合反应或缩聚反应
CH3CHOHCOOCH(CH3)COOH 聚合反应或缩聚反应 ![]()
【解析】
(1)a. 由乳酸![]() 的结构中含有羟基和羧基,在一定条件下,可发生酯化反应(取代反应),故选a项;
的结构中含有羟基和羧基,在一定条件下,可发生酯化反应(取代反应),故选a项;
b. 由乳酸![]() 的结构中不含碳碳双键、碳碳三键之类的不饱和键,因此不能发生加成反应,故不选b项;
的结构中不含碳碳双键、碳碳三键之类的不饱和键,因此不能发生加成反应,故不选b项;
c.由乳酸![]() 的结构中含有羟基,在一定条件下可被氧化为醛基,可发生氧化反应,故选c项;
的结构中含有羟基,在一定条件下可被氧化为醛基,可发生氧化反应,故选c项;
d. 由乳酸![]() 的结构中不含有能加氢的键,所以乳酸不能发生还原反应,故不选d项。
的结构中不含有能加氢的键,所以乳酸不能发生还原反应,故不选d项。
综上所述,本题正确答案为ac。
(2)乳酸的分子式为C3H6O3,且含有羟基和羧基,有3个碳原子,不饱和度为1,则与乳酸含有相同官能团的同分异构体的结构简式为:CH2OHCH2COOH。所以答案为:CH2OHCH2COOH;
(3)乳酸中的羟基与羧基均能与金属钠反应,而只有羧基能与氢氧化钠溶液反应,所以1mol的乳酸与足量的金属钠反应,消耗的金属钠的物质的量为2mol,1mol的乳酸和氢氧化钠溶液反应,消耗的氢氧化钠的物质的量为1mol,则消耗的金属钠与氢氧化钠的物质的量之比是2:1。
(4)两个乳酸分子在一定条件下发生酯化反应,分子间脱水能生成六元环状化合物M,则M的结构简式为: ;分子间脱水又能得到链状化合物N,则N的结构简式为:CH3CHOHCOOCH(CH3)COOH。答案:
;分子间脱水又能得到链状化合物N,则N的结构简式为:CH3CHOHCOOCH(CH3)COOH。答案:  ; CH3CHOHCOOCH(CH3)COOH。
; CH3CHOHCOOCH(CH3)COOH。
(5)可降解一次性餐盒是由乳酸在一定条件下通过缩聚反应生成的高分子材料制得,合成这种高分子材料的化学方程式是![]() ;
;
答案:聚合反应或缩聚反应;![]() 。
。

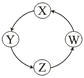
【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号 | X | Y | Z | W |
|
Al | NaAlO2 | Al(OH)3 | Al2O3 | ||
② | Na | NaOH | Na2CO3 | NaCl | |
③ | C | CO | CO2 | H2CO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①② B. ①③④ C. ②③ D. ①④