题目内容
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
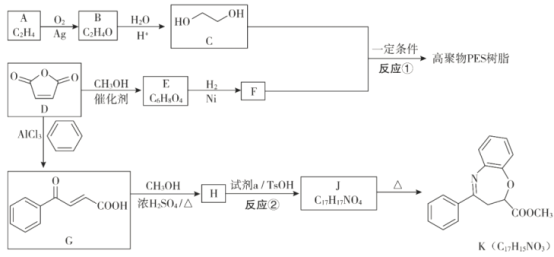
已知:
Ⅰ.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
Ⅱ.R1OH+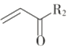
![]()
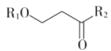
Ⅲ.R1NH2+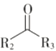
![]()
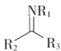 +H2O
+H2O
(R1、R2、R3代表烃基)
(1)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为___________。
(2)E分子中含有两个酯基,D生成E的化学方程式是__________。
(3)反应①的化学方程式为_____________。
(4)反应②所属的反应类型为___________。
(5)试剂a的结构简式为_______________。
【答案】![]()
 +2CH3OH
+2CH3OH![]() H3COOCCH=CHCOOCH3+H2O n
H3COOCCH=CHCOOCH3+H2O n![]() +n
+n![]() →
→ +(2n-1)CH3OH 加成
+(2n-1)CH3OH 加成 
【解析】
由A的分子式可确定A为CH2=CH2;由信息知,B为环氧乙烷![]() ;参照D的结构,E分子中含有两个酯基,则E为H3COOCCH=CHCOOCH3,F为H3COOCCH2CH2COOCH3;从而得出高聚物PES树脂的结构简式为
;参照D的结构,E分子中含有两个酯基,则E为H3COOCCH=CHCOOCH3,F为H3COOCCH2CH2COOCH3;从而得出高聚物PES树脂的结构简式为 。由G的结构简式,可确定H为
。由G的结构简式,可确定H为![]() ;由J的分子式及K的结构,可确定J为
;由J的分子式及K的结构,可确定J为 ,则试剂a为
,则试剂a为![]() 。
。
(1)B分子为环状结构,核磁共振氢谱只有一组峰,且B的分子式为C2H4O,从而得出B的结构简式为![]() 。答案为:
。答案为:![]() ;
;
(2)E分子中含有两个酯基,则E为H3COOCCH=CHCOOCH3,D生成E的化学方程式是![]() +2CH3OH
+2CH3OH![]() H3COOCCH=CHCOOCH3+H2O。答案为:
H3COOCCH=CHCOOCH3+H2O。答案为:![]() +2CH3OH
+2CH3OH![]() H3COOCCH=CHCOOCH3+H2O;
H3COOCCH=CHCOOCH3+H2O;
(3)反应①为![]() 与H3COOCCH=CHCOOCH3反应生成
与H3COOCCH=CHCOOCH3反应生成 ,化学方程式为n
,化学方程式为n![]() +n
+n![]() →
→ +(2n-1)CH3OH。答案为:n
+(2n-1)CH3OH。答案为:n![]() +n
+n![]() →
→ +(2n-1)CH3OH;
+(2n-1)CH3OH;
(4)反应②为![]() 与
与![]() 发生反应生成
发生反应生成 ,所属的反应类型为加成反应。答案为:加成;
,所属的反应类型为加成反应。答案为:加成;
(5)对比![]() 与
与 ,可确定试剂a的结构简式为
,可确定试剂a的结构简式为![]() 。答案为:
。答案为:![]() 。
。