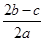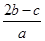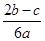题目内容
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 
C
解析试题分析:n(NaOH)=0.01mol;n(Na2CO3)=0.01mol。当向含有这两种物质的混合溶液中加入滴加0.1mol·L-1稀盐酸.首先发生反应:NaOH+HCl="NaCl+" H2O。恰好完全时消耗HCl的体积为0.01mol÷0.1mol/L=0.1L进行滴加时发生反应Na2CO3+HCl= NaHCO3+2NaCl 。恰好完全发生反应时又消耗HCl的体积为0.01mol÷0.1mol/L=0.1L。继续滴加发生反应NaHCO3+HCl="NaCl+" CO2 ↑ + H2O,产生气体,恰好完全发生反应时又消耗HCl的体积为=0.1L。此时产生的气体的体积达到最大值。若再滴加,不再发生任何反应。因此选项为C。
考点:考查HCl与NaOH和Na2CO3混合溶液反应的先后顺序及量的多少对化学反应的影响的知识。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CO2和H2 | C.NaCl和HCl | D.CCl4和KCl |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标况下,11.2L乙烷中含有共价键的数目为3NA |
| B.标况下,22.4LO2和CO2组成的混合物中含有氧原子数为2NA |
| C.常温下,22.4L甲烷中含有的电子数为10NA |
| D.常温下,1 L 0.1mol·L-1的Na2CO3溶液中含OH-离子数为0.1NA |
设NA为阿伏加德罗常数,下列叙述中正确的是
| A.同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为3NA |
C.常温常压下,1mol甲基(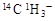 )所含的中子数和电子数分别为8NA、9NA )所含的中子数和电子数分别为8NA、9NA |
| D.在密闭容器中加入28g N2和6g H2,在高温、高压、催化剂的条件下充分反应,生成NH3的分子数为2NA |
用NA表示阿伏加德罗常数,下列结论能够成立的是
| A.0.1 mol·L-1的Na2CO3溶液中含有CO32-的个数是小于0.1NA |
| B.1 molFe与足量稀硝酸完全反应转移的电子数为2NA |
| C.0.2mol·L-1 CuSO4溶液加水稀释至体积增加1倍,其浓度变为0.1 mol·L-1 |
| D.4g NaOH固体溶解1L水中,所得溶液的物质的量浓度为0.1mol/L |
下列叙述正确的是
| A.1 mol·L-1NaCl溶液含有NA个Na+ |
| B.10 mL质量分数为98%的H2SO4用水稀释至100 mL,H2SO4的质量分数应大于9.8% |
| C.配制240 mL 1 mol·L-1的NaOH溶液需称NaOH固体的质量为9.6 g |
| D.配制1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |
设NA表示阿伏加德罗常数的数值。下列有关叙述正确的是( )。
| A.标准状况下,2.24 L庚烷含有的分子数等于0.1 NA |
| B.常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数为0.1 NA |
| C.分子数为NA的CO、C2H4的混合气体体积约为22.4 L,质量为28 g |
| D.3.4 g NH3中含N—H键数目为0.6 NA |