题目内容
5.下列实验操作中,正确的是( )| A. | 稀释浓硫酸先在量筒中加一定体积水,再在不断搅拌下沿量筒壁慢慢加入浓硫酸 | |
| B. | 过滤时,漏斗里的滤液应低于滤纸的边缘 | |
| C. | 燃着的钠应立即用水灭火 | |
| D. | 测定溶液的pH值时,应用湿润玻棒蘸取待测液,直接滴在干燥的pH试纸上 |
分析 A.根据稀释浓硫酸的方法及注意事项分析;
B.为了防止液体溢出,过滤时滤液应该低于滤纸边缘;
C.钠及其燃烧产物过氧化钠能够与水反应生成可燃气体;
D.玻璃棒不能湿润,否则相当于稀释了原溶液,影响测定结果.
解答 解:A.量筒不能用来稀释溶液,配制稀硫酸时,先在烧杯内倒入蒸馏水,再沿烧杯内壁缓慢注入浓硫酸,并不断搅拌,防止液体飞溅,故A错误;
B.过滤时,避免液体溢出,漏斗里的滤液应低于滤纸的边缘,故B正确;
C.钠、过氧化钠都能够与水反应分别生成氢气、氧气,所以不能用水灭火,可以用沙子灭火,故C错误;
D.测定溶液的pH值时,不能用湿润玻棒蘸取待测液,否则待测液的浓度,所以应该用干燥的玻璃棒蘸取待测液,故D错误;
故选B.
点评 本题考查化学实验安全及事故处理,题目难度不大,明确化学实验基本操作方法为解答关键,注意相关基础知识的积累,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
16.下表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小,且Y是地壳中含量最高的金属元素 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
13.核素${\;}_{6}^{14}$C可用于推算出生物死亡的年代.关于${\;}_{6}^{14}$C有关叙述不正确的是( )
| A. | 是一种核素 | B. | 原子核内有8个中子 | ||
| C. | 与${\;}_{6}^{12}$C互为同位素 | D. | 比${\;}_{6}^{13}$C少一个电子 |
20.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 78g过氧化钠固体与足量的水反应,转移的电子数目为2NA | |
| B. | Fe在1molCl2中充分燃烧,转移的电子数目为3NA | |
| C. | 将含有0.1molFeCl3的FeCl3饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA | |
| D. | 足量的MnO2粉末与含有4molHCl的浓盐酸充分反应,转移的电子数目为2NA |
15.下列关于乙烯和乙烷相比较的说法中,不正确的是( )
| A. | 乙烯属于不饱和烃,乙烷属于饱和烃 | |
| B. | 乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不在同一平面上 | |
| C. | 乙烯和乙烷燃烧现象相同,完全燃烧产物也相同 | |
| D. | 乙烯能使酸性高锰酸钾溶液褪色,乙烷不能 |
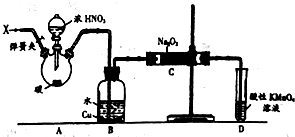 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备硝酸钠的装置如图所示.
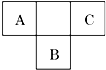 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.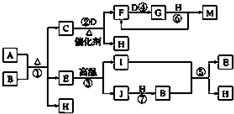 已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液体,M为三大强酸之一.反应②③④⑥为工业生产中重要的反应.等物质的量的A、B充分混合后加热能恰好完全反应(如图所示),E的式量为100.图中反应条件(除加热外)均已略去.
已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液体,M为三大强酸之一.反应②③④⑥为工业生产中重要的反应.等物质的量的A、B充分混合后加热能恰好完全反应(如图所示),E的式量为100.图中反应条件(除加热外)均已略去.