题目内容
20.煅烧硫铁矿(主要成分为FeS2)的反应为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.试回答下列问题.(1)可用哪些物质来表示该反应的化学反应速率SO2和O2.
(2)某时刻时测得,生成SO2的速率为0.64mol/(L•s),则氧气减少的速率为0.88 mol/(L•s).
(3)该工业生产中将矿石粉碎的目的:增大接触面积,加快反应速率 .
分析 (1)只有气体或者溶液才有浓度的变化,固体或者纯液体的浓度是定值;
(2)根据v=$\frac{△c}{△t}$,化学反应速率之比等化学计量数之比进行计算;
(3)矿石粉碎增大接触面积加快反应速率.
解答 解:(1)4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,化学反应速率是指单位时间内反应物浓度减小或生成物浓度增大表示,只有气体或者溶液才有浓度的变化,固体或者纯液体的浓度是定值,反应能用来表示化学反应速率的物质不能是固体和纯液体,反应中用来表示反应速率的物质为SO2和O2,
故答案为:SO2和O2;
(2)v(SO2):v(O2)=8:11,故v(O2)=$\frac{11}{8}$v(SO2)=$\frac{11}{8}$×0.64=0.88 mol/(L•s),故答案为:0.88 mol/(L•s);
故答案为:0.88;
(3)该工业生产中将矿石粉碎的目的是增大接触面积,加快反应速率,
故答案为:增大接触面积,加快反应速率.
点评 本题考查化学反应速率的相关计算,把握化学反应速率之比等化学计量数之比为解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11. 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如表所示:
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如表所示:
已知:西红柿、苹果果汁都是显酸性.
(1)该实验的目的是探究水果种类和电极间距离对水果电池电流大小的影响.
(2)能表明水果种类对电流大小有影响的实验编号是②和③.
(3)图所示的装置中,负极的电极反应式为Zn-2e-=Zn2+,正极附近区域c(H+)将减小(填“增大”、“减小”、“不变”),总反应离子方程式为Zn+2H+=Zn2++H2↑.
 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如表所示:
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如表所示:已知:西红柿、苹果果汁都是显酸性.
| 实验编号 | 水果种类 | 电极间距离/cm | 电流大小/?A |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹果 | 2 | 27.2 |
(2)能表明水果种类对电流大小有影响的实验编号是②和③.
(3)图所示的装置中,负极的电极反应式为Zn-2e-=Zn2+,正极附近区域c(H+)将减小(填“增大”、“减小”、“不变”),总反应离子方程式为Zn+2H+=Zn2++H2↑.
8.下列关于金属冶炼的叙述正确的是( )
| A. | 工业上可利用铝热反应大量冶炼金属铁 | |
| B. | 金属钠、铝和铜都可用热还原法制备 | |
| C. | CO还原磁铁矿得到9 mol铁时转移24 mol电子 | |
| D. | 电解饱和氯化镁溶液可得金属镁 |
15.不能达到除杂目的是(括号内物质为少量杂质)( )
| A. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| D. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,振荡静置后,分液 |
5.常温下,下列溶液一定呈碱性的是( )
| A. | 能与金属铝反应放出氢气的溶液 | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-6的溶液 | |
| C. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合 | |
| D. | 0.01 mol•L-1的氨水与0.01 mol•L-1的HCl溶液等体积混合 |
12.以下为三种有机物的有关信息,根据表中信息回答问题.
(1)A结构简式是CH2=CH2.该物质能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色.其中,与高锰酸钾溶发生的反应是氧化反应(填反应类型);与溴反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,当溴的四氯化碳溶液质量增加2.8g时,生成物的质量为18.8g.
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为 .
.
(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为CH4+2Cl2$\stackrel{光照}{→}$CH2Cl2+2HCl.
| A | B | C |
| 其产量用来衡量一个国家的石油化工水平. | 比例模型为: | 沼气主要成分 |
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为
 .
.(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为CH4+2Cl2$\stackrel{光照}{→}$CH2Cl2+2HCl.
9.如图为铜锌原电池示意图,下列说法正确的是( )
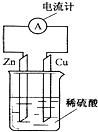

| A. | 锌片逐渐溶解 | B. | 电子由铜片通过导线流向锌片 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
15.下列说法正确的是( )
| A. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 | |
| B. | 对苯二甲酸( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(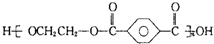 ) ) | |
| C. | 分子式为C9H10O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成CO2气体,满足以上2个条件的该有机物的同分异构体有6种 | |
| D. | 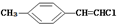 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |