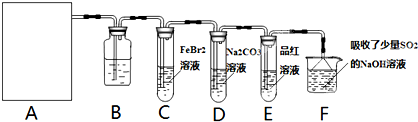
��Ŀ����
 ������һ����Ҫ�Ļ���ԭ�ϣ���������������Ӧ��ʮ�ֹ㷺��
������һ����Ҫ�Ļ���ԭ�ϣ���������������Ӧ��ʮ�ֹ㷺����֪��2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+5Cl2��+8H2O����ʵ���ҿ��ö������̹���������ع����Ũ���ᷴӦ��ȡ�������ɹ�ѡ�õķ���װ����ͼ��
��1�����ø�����ع����Ũ���ᷴӦ��ȡ����������װ����
��2�����ø�����ع����Ũ���ᷴӦ��ȡ����������0.1mol���ӷ���ת��ʱ�����ɵ������ڱ�״���µ����Ϊ
��3��д���ö������̹����Ũ���ᷴӦ��ȡ�����Ļ�ѧ����ʽ��
��4��ʵ�����ռ������ķ�����
��5������NaOH��Һ����������ֹ��Ⱦ��д���÷�Ӧ�Ļ�ѧ����ʽ��
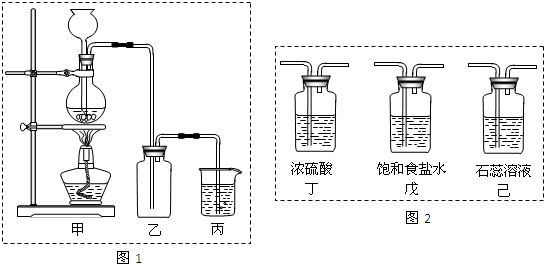
��������1�����ݸ������Ϊ�����Ũ����ΪҺ�壬�Լ���Ӧ����Ҫ���ȣ��������ͼ��ѡ����װ�ã�
��2������ת�Ƶ����������ɵ����������ʵ���֮��Ĺ�ϵ��ϻ�ѧ����ʽ���м��㣻
��3��Ũ����Ͷ������̼��ȷ�Ӧ�����Ȼ��̡�������ˮ��
��4����������ˮ���ܶȱȿ��������������ſ��������������ű���ʳ��ˮ�����ռ�������
��5������������������Һ��Ӧ�����Ȼ��ơ�����������ˮ��
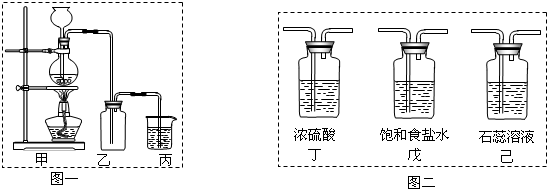
��2������ת�Ƶ����������ɵ����������ʵ���֮��Ĺ�ϵ��ϻ�ѧ����ʽ���м��㣻
��3��Ũ����Ͷ������̼��ȷ�Ӧ�����Ȼ��̡�������ˮ��
��4����������ˮ���ܶȱȿ��������������ſ��������������ű���ʳ��ˮ�����ռ�������
��5������������������Һ��Ӧ�����Ȼ��ơ�����������ˮ��
����⣺��1��Aװ�������ڹ�������Ʊ����壬Bװ�������ڹ���+Һ������Ʊ����壬Cװ�������ڹ���+Һ������Ʊ����壮���ø�����ع����Ũ���ᷴӦ��ȡ�������������Ϊ�����Ũ����ΪҺ�壬��Ӧ����Ҫ���ȣ���Bװ���ʺϣ�
�ʴ�Ϊ��B��
��2����Ӧ2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+5Cl2��+8H2O��ת�Ƶ���10mol������10mol����ת��ʱ���������������ʵ�����5mol������0.1mol���ӷ���ת��ʱ���������������ʵ�����0.05mol��״����0.05mol���������V=n��Vm=0.05mol��22.4L/mol=1.12L��
�ʴ�Ϊ��1.12��
��3��Ũ������������̼��ȷ�Ӧ����ȡ�����Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O��
��4����������ˮ���ܶȱȿ��������������ſ��������������ű���ʳ��ˮ�����ռ�������
�ʴ�Ϊ�������ſ��������������ű���ʳ��ˮ������
��5������������������Һ��Ӧ�����Ȼ��ơ�����������ˮ����Ӧ���ӷ���ʽΪCl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��B��
��2����Ӧ2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+5Cl2��+8H2O��ת�Ƶ���10mol������10mol����ת��ʱ���������������ʵ�����5mol������0.1mol���ӷ���ת��ʱ���������������ʵ�����0.05mol��״����0.05mol���������V=n��Vm=0.05mol��22.4L/mol=1.12L��
�ʴ�Ϊ��1.12��
��3��Ũ������������̼��ȷ�Ӧ����ȡ�����Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��
| ||
�ʴ�Ϊ��MnO2+4HCl��Ũ��
| ||
��4����������ˮ���ܶȱȿ��������������ſ��������������ű���ʳ��ˮ�����ռ�������
�ʴ�Ϊ�������ſ��������������ű���ʳ��ˮ������
��5������������������Һ��Ӧ�����Ȼ��ơ�����������ˮ����Ӧ���ӷ���ʽΪCl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��Cl2+2NaOH=NaCl+NaClO+H2O��
���������⿼��������������ʵ�����Ʊ����Ѷ��еȣ�ע�ⷴӦ����װ�õ�ѡ���뷴Ӧ���״̬��Ӧ�������йأ��ռ�װ�õ�ѡ������������������ʣ�

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ