题目内容
9.pH值相同的HCl、H2SO4、CH3COOH各100毫升(1)三种溶液中物质的量浓度最大的是CH3COOH.
(2)分别用0.1mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是CH3COOH.
(3)加入NaOH溶液,反应开始时,反应速率D(填序号).
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快.
分析 (1)HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比;
(2)分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比;
(3)反应速率与氢离子浓度成正比.
解答 解:(1)HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比,所以pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)溶液其浓度大小顺序是CH3COOH>HCl>H2SO4,则浓度最大的是CH3COOH;
故答案为:CH3COOH;
(2)分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比,pH相等、体积相等的硫酸和盐酸中氢离子的物质的量相等,醋酸的物质的量浓度最大,则相同体积同pH的醋酸和盐酸,醋酸的物质的量大于盐酸,所以消耗氢氧化钠体积最多的是CH3COOH;
故答案为:CH3COOH;
(3)反应速率与氢离子浓度成正比,开始时,三种酸中氢离子浓度相等,所以其开始反应速率相等,故答案为:D.
点评 本题考查较综合,涉及弱电解质的电离、酸碱混合溶液定性判断、反应速率的判断等知识点,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
19.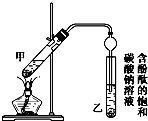 已知下列数据:
已知下列数据:
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液.
②按如图所示连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置分层.
④分离出乙酸乙酯,洗涤、干燥.
(1)配制①中混合溶液的方法为应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸;
反应中浓硫酸的作用是催化剂 吸水剂;写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填字母).
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇 C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是减少乙酸乙醇的挥发,减少副反应的发生;步骤③所观察到的现象是试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应从仪器上口倒(填“下口放”或“上口倒”)出.
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如表:
表中数据x的范围是1.57<X<1.76;实验①②⑤探究的是增加乙醇或乙酸的用量对酯产量的影响.
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液.
②按如图所示连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置分层.
④分离出乙酸乙酯,洗涤、干燥.
(1)配制①中混合溶液的方法为应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸;
反应中浓硫酸的作用是催化剂 吸水剂;写出制取乙酸乙酯的化学方程式:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
(2)上述实验中饱和碳酸钠溶液的作用是BC(填字母).
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇 C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是减少乙酸乙醇的挥发,减少副反应的发生;步骤③所观察到的现象是试管乙中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应从仪器上口倒(填“下口放”或“上口倒”)出.
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如表:
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
20.下列属于同系物的是( )
①金刚石与“足球烯”C60
②D与T
③16O、17O和18O
④氧气(O2)与臭氧(O3)
⑤CH4和CH3CH2CH3
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑦ 和
和
⑧ 和
和
①金刚石与“足球烯”C60
②D与T
③16O、17O和18O
④氧气(O2)与臭氧(O3)
⑤CH4和CH3CH2CH3
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
⑦
 和
和
⑧
 和
和
| A. | ①④ | B. | ⑤⑦ | C. | ⑥⑧ | D. | ②③ |
4.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA | |
| B. | 由2H和18O所组成的水11 g,其中所含的中子数为4NA | |
| C. | 常温下丁烯和环丙烷组成的42 g混合气体中H原子数为6NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA |
14.下列各组中的离子,能在无色透明的溶液中大量共存的是( )
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | ||
| C. | Na+、H+、Cu2+、SO${\;}_{4}^{2-}$ | D. | K+、Zn2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
1.下列反应过程符合如图所示关系的是( )


| A. | 向漂白粉溶液中通入CO2气体至过量 | |
| B. | 向Na2SiO3溶液中通入HCl气体至过量 | |
| C. | 向Ba(OH)2和KOH混合溶液中通入CO2气体至过量 | |
| D. | 向Na[Al(OH)4]溶液中通入HCl气体至过量 |
18.海水是巨大的资源宝库.如图是人类从海水资源获取某些重要化工原料的流程示意图.

回答下列问题:
(1)操作A是蒸发结晶(填实验基本操作名称).要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是b.
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是c(选填编号).
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)操作C是热空气吹出;上图中虚线框内流程的主要作用是富集Br2.
(4)图中虚线框内流程也可用 替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2
替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2
(5)已知苦卤的主要成分如表:
理论上,1L苦卤最多可得到Mg(OH)2的质量为69.6g.

回答下列问题:
(1)操作A是蒸发结晶(填实验基本操作名称).要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是b.
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是c(选填编号).
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)操作C是热空气吹出;上图中虚线框内流程的主要作用是富集Br2.
(4)图中虚线框内流程也可用
 替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2
替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2(5)已知苦卤的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
19.下列操作能达到实验目的是( )
| A. | 向沸腾的NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 加热除去碳酸氢钠中少量氯化铵 | |
| C. | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中,观察过氧化钠的颜色 | |
| D. | 用排四氯化碳法收集氨气、氯化氢 |