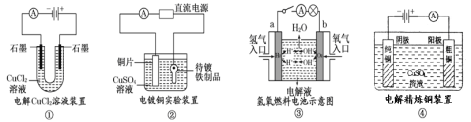
题目内容
【题目】草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,110 ℃可完全失去结晶水,是制备某些铁触媒的主要原料。实验室通过下列方法制备Ka[Fe(C2O4)b]·cH2O并测定其组成:
Ⅰ.草酸合铁酸钾晶体的制备
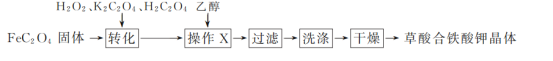
(1)“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:_________________________。
(2)“操作X”中加入乙醇的目的是_______________________。
Ⅱ. 草酸合铁酸钾组成的测定
步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
(3)若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量________(填“偏大”“偏小”或“不变”)。
(4)通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。 ________
【答案】H2O2+H2C2O4=2CO2↑+2H2O 降低草酸合铁酸钾的溶解度,促进草酸合铁酸钾的析出 偏小 K3[Fe(C2O4)3]·3H2O
【解析】
(1)H2O2具有氧化性,草酸具有还原性,二者会发生氧化还原反应,结合电子守恒、原子守恒书写;
(2)根据草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,结合实验目的分析;
(3)若不洗涤,在固体表明会残留K+,据此判断K+的多少;
(4)先根据盐失重质量计算结晶水的物质的量,根据Cl-+Ag+=AgCl↓,由消耗AgNO3的物质的量计算Cl-的物质的量,再交换树脂的交换柱反应中微粒关系由Cl-得到K+及[Fe(C2O4)b]a-的物质的量,再根据化合物中化合价代数和等于0及固体在受热分解前后质量关系,找出a、b的关系,求出微粒物质的量的比,最后得到物质化学式。
(1)H2O2具有氧化性,草酸具有还原性,二者会发生氧化还原反应,根据反应过程在电子守恒、原子守恒,可得反应方程式为:H2O2+H2C2O4=2CO2↑+2H2O;
(2)由于草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,为降低草酸合铁酸钾的溶解度,促进草酸合铁酸钾的析出,因此要使用乙醇;
(3)若步骤3中未用蒸馏水冲洗交换柱,则一部分K+残留在交换柱内,使测得的样品中K+的物质的量偏少;
(4)0.4910 g的草酸合铁酸钾n(H2O)=(0.4910-0.4370)g÷18 g/mol=3×10-3 mol;
n(Cl-)=n(Ag+)=0.1500 mol/L×20.00×10-3 L=3×10-3 mol,根据离子交换柱中发生的反应:
a RCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-,可得样品中n(K+)=n(Cl-)=3×10-3 mol,n{[Fe(C2O4)b]a-}=![]() mol;110 ℃残留固体是晶体失去结晶水后的产物即K+和[Fe(C2O4)b]a-的总质量,则3×10-3 mol×39 g/mol+
mol;110 ℃残留固体是晶体失去结晶水后的产物即K+和[Fe(C2O4)b]a-的总质量,则3×10-3 mol×39 g/mol+![]() mol×(56+88b)g/mol=0.437 0 g
mol×(56+88b)g/mol=0.437 0 g
Ka[Fe(C2O4)b]中根据电荷守恒关系可得:a+3=2b,解得a=3,b=3,n{[Fe(C2O4)3]3-}=1×10-3 mol,
n(K+):n{[Fe(C2O4)3]3-}:n(H2O)=(3×10-3 mol):(1×10-3 mol):(3×10-3 mol)= 3∶1∶3,
所以该盐化学式为K3[Fe(C2O4)3]·3H2O。

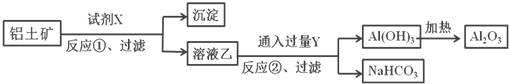
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、FeO、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如图:
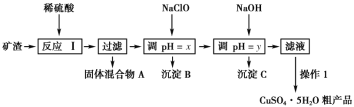
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是__(任写1条)。
(2)固体混合物A中的成分是__。
(3)反应Ⅰ完成后,铁元素的存在形式为__(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式__。
(4)操作1主要包括:__、__、__。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是__。
(5)用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为__,该反应中氧化剂与还原剂的物质的量之比为__。
(6)用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为__。