题目内容
5. 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下:X:气态氢化物的水溶液呈弱碱性; Y:第三周期元素的简单离子中离子半径最小;
Z:用量最大、用途最广的金属单质;Q:位于第二周期且族序数是周期数的2倍;
R:最外层电子数是次外层电子数的3倍.
请根据上述信息回答下列问题:
(1)Z在周期表中的位置为第四周期第Ⅷ族,Q中含有8个中子的原子组成符号是146C.
(2)上述五种元素中有两种元素分别和R形成化合物M、N,它们:摩尔质量、分子中所含原子数、分子中的核外电子数都相同,写出M、N中任意一个的化学式CO2或N2O.
(3)X与元素周期表中第一号元素形成的10电子阳离子的空间构型为正四面体.X的最高价氧化物对应的水化物其浓溶液与同类物质相比在化学性质上表现的特殊性有不稳定性和强氧化性.
(4)已知:A、B、C为均含有Y元素或均含有Z元素的三种无机物,它们存在如下图所示的相互转化关系.请回答下列问题:
①若D为氯碱工业的重要产品,写出反应(Ⅲ)的离子方程式:Al3++3AlO2-+6H2O=4Al(OH)3↓.
②若D为稀硝酸,则检验B溶液中阳离子时,所加入试剂正确的是b.(填序号)
a.先加双氧水后加KSCN溶液 b.先加KSCN溶液后加双氧水.
分析 X元素的气态氢化物的水溶液呈弱碱性,则X为N元素; Y元素是第三周期元素的简单离子中离子半径最小,则Y为Al;Z是用量最大、用途最广的金属单质,则Z为Fe;Q位于第二周期且族序数是周期数的2倍,则Q为C元素;R元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则R为O元素.
(4)A、B、C为均含有Al元素或均含有Fe元素的三种无机物,①若D为氯碱工业的重要产品,则A为铝盐、D为NaOH、B为Al(OH)3,C为NaAlO2;
②若D为稀硝酸,则A为Fe,B为硝酸亚铁,C为硝酸铁.
解答 解:X元素的气态氢化物的水溶液呈弱碱性,则X为N元素; Y元素是第三周期元素的简单离子中离子半径最小,则Y为Al;Z是用量最大、用途最广的金属单质,则Z为Fe;Q位于第二周期且族序数是周期数的2倍,则Q为C元素;R元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则R为O元素.
(1)Z为Fe元素,在周期表中的位置为:第四周期第Ⅷ族,Q为碳元素,含有8个中子的原子组成符号是146C,
故答案为:第四周期第Ⅷ族;146C;
(2)上述五种元素中有两种元素分别和R形成化合物M、N,它们:摩尔质量、分子中所含原子数、分子中的核外电子数都相同,也属于等电子体,应为CO2或N2O,故答案为:CO2或N2O;
(3)X与元素周期表中第一号元素形成的10电子阳离子为NH4+,的空间构型为正四面体,X的最高价氧化物对应的水化物为硝酸,其浓溶液与同类物质相比在化学性质上表现的特殊性有:不稳定性和强氧化性,
故答案为:正四面体;不稳定性和强氧化性;
(4)A、B、C为均含有Al元素或均含有Fe元素的三种无机物,①若D为氯碱工业的重要产品,则A为铝盐、D为NaOH、B为Al(OH)3,C为NaAlO2,反应(Ⅲ)的离子方程式:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
②若D为稀硝酸,则A为Fe,B为硝酸亚铁,C为硝酸铁,检验B溶液中亚铁离子时:先加KSCN溶液,溶液不变红色,再加双氧水,溶液变为红色,说明含有亚铁离子,故答案为:b.
点评 本题考查元素化合物的推断,推断元素是解题关键,注意对基础知识的理解掌握.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 甲有可能是AlO2- 也有可能是Al3+ | |
| B. | 若乙为无色无味气体,则甲一定是CO32- | |
| C. | 若甲是具有刺激性气味的气体,则甲、乙具有相同的电子数 | |
| D. | 若甲、乙均为离子,甲、乙两种离子在同一溶液中一定不能大量共存 |
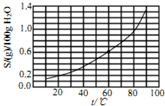
| A. | 25℃时,溴酸银微溶于水 | |
| B. | 溴酸银溶解度随温度升高而增大 | |
| C. | 60℃时溴酸银的Kap约等于2.5×10-4 | |
| D. | 往溴酸银浊液中滴加NaI有黄色固体生成 |
| A. | 分液时,水溶液一定从下口放出 | |
| B. | 蒸馏时,如果温度计水银球下端高于蒸馏烧瓶支管口上沿,收集到的馏分沸点偏高 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 量取20.0mL浓硫酸时,俯视读数,所取液体体积偏大 |
| A. | 2FeC12+C12=2FeC13 | B. | Fe+CuSO4=Cu+FeSO4 | ||
| C. | C12+2NaOH=NaC1+NaC1O+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
| A. | 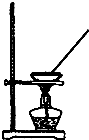 如图所示装置获得碳酸氢钠固体 | B. | 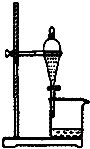 如图所示装置分离乙酸和乙酸乙酯 | ||
| C. | 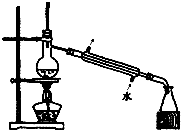 如图所示装置制取少量蒸馏水 | D. | 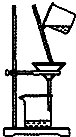 如图所示装置提纯氢氧化铁胶体 |
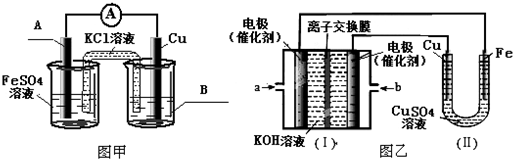
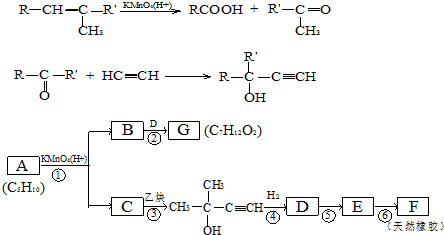
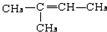 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2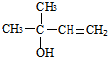 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$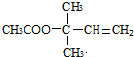 +H2O;
+H2O; .
.