题目内容
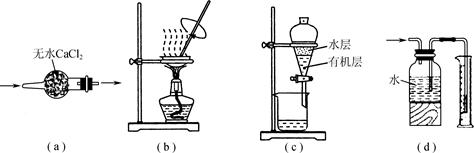
(13分)一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷:
某学生的实验过程和具体操作可简述如下:
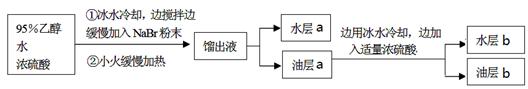
查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是 。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有 ,检验该离子的方法是 。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率 (用小数表示,保留二位小数)。

某学生的实验过程和具体操作可简述如下:

查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是 。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有 ,检验该离子的方法是 。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
| 实验步骤 | 预期现象和结论 |
| 步骤1:将油层b转移至 中,再加入足量稀 Na2SO3溶液充分振荡,静置。 | |
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。 | 溶液分层,下层呈橙红色,证明 。 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中, 至温度计升高至450C左右。 | 馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。 |
(13分)
(1)防止产品挥发损失(1分)
(2)SO42-(1分),取少量水层a的溶液于试管中,加入足量稀盐酸化,再滴加少量的BaCl2溶液,若产生浑浊,有SO42-,否则无SO42-。(2分)
(3)
(4)0.67 (2分)
(1)防止产品挥发损失(1分)
(2)SO42-(1分),取少量水层a的溶液于试管中,加入足量稀盐酸化,再滴加少量的BaCl2溶液,若产生浑浊,有SO42-,否则无SO42-。(2分)
(3)
| 实验步骤 | 预期现象和结论 |
| 分液漏斗 (1分) | 液体分层,下层液体逐渐褪为无色。(2分) |
| | 油层b中含有Br2(2分) |
| 水浴加热 (2分) | |
试题分析:(1)一溴乙烷的沸点较低,易挥发,所以锥形瓶置于冰水混合物中的目的是防止产品挥发损失;
(2)制备一溴乙烷所用试剂有浓硫酸,所以水层a中的离子除Na+、H+、OH-和Br-外,一定还有SO42-;SO42-的检验方法是取少量水层a的溶液于试管中,加入足量稀盐酸化,再滴加少量的BaCl2溶液,若产生浑浊,有SO42-,否则无SO42-。
(3)步骤2中溶液出现分层现象,所以将油层b转移至分液漏斗中,便于分离溶液;一溴乙烷中可能含有CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2等杂质,而使溶液显黄色。一溴乙烷的密度比水大,Na2SO3溶液可以吸收Br2、SO2在溶液的上层,一溴乙烷等油层在溶液的下层,所以出现的现象是液体分层,下层液体逐渐褪为无色;步骤2中用新制氯气和四氯化碳溶液萃取,溶液分层,下层呈橙红色,证明原油层中b中含有Br2;步骤1的油层中含有一溴乙烷、CH2BrCH2Br等,一溴乙烷的沸点较低,所以控制温度在38℃左右时溜出的馏分是一溴乙烷,常用水浴加热的方法,控制温度。
(4)乙醇的物质的量大于溴化钠的物质的量,所以理论上生成0.15mol的一溴乙烷,实际得到10.9g/0.1mol的一溴乙烷,所以产率=0.1mol/0.15mol=0.67.

练习册系列答案
相关题目