题目内容
【题目】A、B、C、D、E五种物分别是NaOH、NH3H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①0.001mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B<D;
③E是弱电解质.回答下列问题:
(1)D是溶液,判断理由是 .
(2)用水稀释0.1molL﹣1 B时,溶液中随着水量的增加而减小的是(填写序号).
① ![]() ②
② ![]() ③c(H+)和c(OH﹣)的乘积 ④OH﹣的物质的量
③c(H+)和c(OH﹣)的乘积 ④OH﹣的物质的量
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的曲线(填写序号).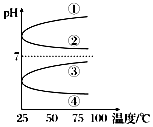
(4)OH﹣浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是(填写序号).
①反应所需要的时间E>A
②开始反应时的速率A>E
③参加反应的锌的物质的量A=E
④反应过程的平均速率E>A
⑤A溶液里有锌剩余
⑥E溶液里有锌剩余.
【答案】
(1)NaOH;中和酸性物质A只有NaOH、NH3?H2O,等物质的量的A与等物质的量浓度B和D混合呈中性,D用的体积少,说明D碱性比B的碱性强,所以D是NaOH
(2)①
(3)④
(4)③④⑤
【解析】解:①0.001mol/L的A溶液pH=3,所以A是一元强酸,是盐酸;②NaOH和NH3H2O溶液显碱性,等浓度两者PH关系B<D,所以D是氢氧化钠,B是氨水;③E是弱电解质,则是CH3COOH,所以C为NH4HSO4 , (1)D是氢氧化钠溶液,判断理由是中和酸性物质A只有NaOH、NH3H2O,等物质的量的A与等物质的量浓度B和D混合呈中性,D用的体积少,说明D碱性比B的碱性强,所以D是NaOH,所以答案是:NaOH;中和酸性物质A只有NaOH、NH3H2O,等物质的量的A与等物质的量浓度B和D混合呈中性,D用的体积少,说明D碱性比B的碱性强,所以D是NaOH;(2)①用水稀释氨水,电离平衡向电离方向移动,n(NH3H2O)减小,n(OH﹣)增大,溶液体积不变,浓度之比等于物质的量之比, ![]() 减小,故正确;②用水稀释氨水,电离平衡向电离方向移动,n(NH3H2O)减小,n(OH﹣)增大,所以氢离子的浓度减少,则
减小,故正确;②用水稀释氨水,电离平衡向电离方向移动,n(NH3H2O)减小,n(OH﹣)增大,所以氢离子的浓度减少,则 ![]() 增大,故错误;③温度不变,c(H+)和c(OH﹣)的乘积不变,故错误; ④OH﹣的物质的量增大,故错误;所以答案是:①;(3)等体积、等物质的量浓度B和C混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,PH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,PH减小,③错误、④正确,所以答案是:④;(4)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+ , 反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+ , 反应速率比盐酸中快,故④正确;⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;所以答案是:③④⑤.
增大,故错误;③温度不变,c(H+)和c(OH﹣)的乘积不变,故错误; ④OH﹣的物质的量增大,故错误;所以答案是:①;(3)等体积、等物质的量浓度B和C混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,PH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,PH减小,③错误、④正确,所以答案是:④;(4)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+ , 反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+ , 反应速率比盐酸中快,故④正确;⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;所以答案是:③④⑤.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 备战中考寒假系列答案
备战中考寒假系列答案【题目】甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
化学反应 | 平衡常温 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.5 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g) | K3 | ||
(1)反应②是(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(p)的关系如图甲所示.则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”“<”或“=”). 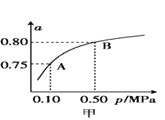
(3)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示).500℃时测得反应③在某时刻时,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(molL﹣1)分别为0.8、0.1、0.3、0.15,则此时v正v逆(填“>”“=”或“<”).
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)﹣t(反应时间)变化曲线Ⅰ如图乙所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是
当曲线Ⅰ变为曲线Ⅲ时,改变的条是 . 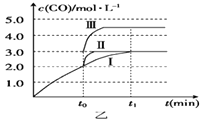
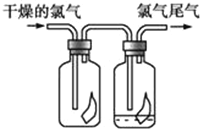
【题目】(1)浓硫酸与木炭粉在加热条件下反应的化学方程式为_______________________。
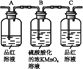
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(2)试用表中所示各装置设计一个实验,验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号) → → → 。______________
(3)实验室中可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。B瓶溶液的作用是___________;C瓶溶液的作用是________________。
(4)装置②中所加的固体药品是__________。
(5)装置③中所盛的溶液是___________,可验证的产物是________。